作者简介:王志林,男,1972年生,硕士,副主任技师,主要从事血液病研究。
目的探讨弥漫性大B细胞淋巴瘤(DLBCL)免疫表型分类与
Objective To investigate the correlation between immunophenotype and
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(NHL)最常见的组织学类型[ 1],占成人淋巴瘤的30%~40%。根据基因表达特征可将DLBCL分成2种亚型:一种为生发中心B细胞样(germinal center B-cell-like,GCB);另一种为非生发中心B细胞样(non-GCB),又称活化B细胞样(activated B-cell-like,ABC)[ 2]。也可以利用CD10、B细胞淋巴瘤原癌基因-6(BCL-6)及多发性骨髓瘤原癌基因-1(MUM-1)免疫标志物来对DLBCL进行分类:CD10(+)则为GCB类,当CD10(–)且BCL-6(–)时则为non-GCB类;若CD10(–)、BCL-6(+)时则要检测MUM-1,如果MUM-1(+)则为non-GCB类,反之为GCB类DLBCL[ 3]。 c-MYC是一种原癌基因,与细胞周期密切相关[ 4]。关于DLBCL患者中 c-MYC重排情况国内未见相应报道,为此我们应用荧光原位杂交(FISH)技术检测了DLBCL患者 c-MYC重排情况。
收集来自常州市第一人民医院病理科2009年5月至2011年3月诊断明确的DLBCL标本共46例,所有病例诊断均符合2001年世界卫生组织(WHO)淋巴瘤分类标准:DLBCL形态表现为弥漫增生的大淋巴细胞,瘤细胞核的体积比正常小淋巴细胞大2倍以上或等于及超过巨噬细胞核,核呈空泡状,核仁明显,核分裂相易见。这些标本已经用CD10、BCL-6、MUM-1 3种免疫标志物进行了分类。选择8例扁桃体反应性增生患者标本作为对照组,DLBCL组和对照组同时做FISH检测。
1. 免疫组化染色步骤 免疫组化试剂购自北京中杉金桥生物技术有限公司,采用常规免疫组化检测方法。结果判读采用北京中杉金桥生物技术有限公司阳性结果判断标准:CD10阳性定位于细胞膜,BCL-6、MUM-1阳性定位于细胞核,以>20%的肿瘤细胞着色判为阳性。
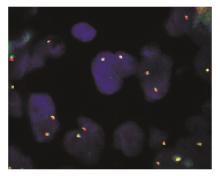
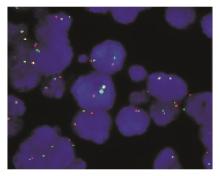
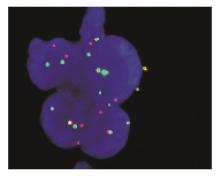
2. FISH技术 试剂为北京金菩嘉医疗科技有限公司生产,GLP MYC探针位于8q24,采用SpecteumGreen和SpecteumRed标记的DNA序列,在正常间期细胞中表现为2个黄色融合信号,出现相互分离的橘红色信号、绿色信号和一个黄色融合信号或2个橘红色信号和2个绿色信号判断为阳性。
具体步骤:取出用4%甲醛固定、石蜡包埋的组织标本,使用切片机切下2~3 μm的石蜡片。根据苏木精-伊红(HE)染色,选择富含淋巴瘤细胞的区域,用钻石笔在切片背后做标记(画小圆圈)以示所需杂交的位置。而在反应性增生的扁桃体的切片背后也标记好组织所在的部位。然后对做好标记的切片进行烤片至产生小蜡珠,脱蜡,二甲苯浸泡各2次,每次10 min。100 %乙醇浸泡5 min,洗去二甲苯;复水,100 %、85 %、70 %乙醇浸泡2 min;煮片,在高压锅中煮10 min;消化,胃酶,40 mL蒸馏水中400 μL 1 mol/L HCl,然后加入240 μL的20 mg/mL胃蛋白酶,不同样本的时间不同,一般是30~60 min;2×氯化钠-柠檬酸钠溶液(SSC),脱水2次各5 min;甲醛固定10 min;脱水,70 %、85 %、100 %乙醇脱水各2 min。
探针处理:每份标本取探针1 μL,加杂交稀释液4 μL混匀,将探针混合液5 μL加于玻片的待杂交区,盖上盖玻片。用Rubber Cement封片后,放于ThermoBrite自动原位杂交仪中,程序设定83 ℃变性5 min,42 ℃杂交20 h。杂交结束后,洗片,去除盖玻片,将玻片置于46 ℃的0.3 % NP-40/0.4×SSC中洗涤2 min,再置于室温0.1% NP-40/2×SSC 中洗涤45 s,置于2×SSC中脱水4 min,再置于70 %的酒精中脱水4 min,取出玻片,晾干,复染,吸取10 μL的4,6二脒基-2-苯吲哚盐酸(DAPI)于杂交区,置于4 ℃冰箱,待30 min后观察结果。
检测:用OLYMPUS BX51正置荧光显微镜在DAPI/FITC/RHOD滤光片的激发下,观察细胞红色和绿色荧光杂交信号,每份标本至少分析100个细胞,计数边界清楚、无重叠、结构完整的细胞核,用德国耶拿CCD摄像头进行图像采集,使用IMSTAR软件进行图像分析。
使用SPSS 13.0统计学软件进行分析,计数资料采用校正的 χ2检验, P<0.05为差异有统计学意义。
8例扁桃体反应性增生的标本细胞核中GLP MYC杂交信号为2个红色荧光和绿色荧光相邻重叠的黄色信号,见 图1,如发生 c-MYC重排,则MYC荧光信号断裂成红色和绿色2个荧光杂交信号,即红色和绿色荧光杂交信号标分离。每份标本分析200个细胞,出现红色和绿色荧光杂交信号相分离的细胞是 c-MYC重排假阳性细胞,以阳性细胞数>
DLBCL是WHO分类中最常见的高度恶性淋巴瘤,只有40%~50%的患者可获得缓解,提示DLBCL可能存在不同类型[ 5]。由于该肿瘤临床表现多样,病理形态及遗传学特征复杂,长期以来对其分型和预后判断存在认识上的分歧。DLBCL在细胞起源、基因表达、分子遗传学特点、免疫表型及临床表现方面均有明显的异质性,不同的DLBCL其治疗反应不同,预后也不同,因此对DLBCL进行分类尤为重要。
2000年以来,经DNA微阵列和免疫组化研究发现,依据基因表达谱和免疫表型可初步将DLBCL分为GCB和non-GCB两大类型。这2类基因表达不同的DLBCL,其5年生存率分别为70%和12%,GCB类DLBCL的预后明显好于non-GCB类型[ 2, 3]。
c-MYC基因定位于8q24,由3个外显子及2个内含子组成,第1个外显子不编码,只起调节作用,只有外显子2和3是编码区,外显子1、2、3共同编码的蛋白质定位于核内,为核转录调节因子。 c-MYC编码的蛋白通过螺旋-环-螺旋-亮氨酸拉链(bHLH-LZIP)区与同样含有bHLH-LZIP结构的MAX蛋白形成异二聚体,特异地识别其靶基因DNA序列中的CACGTG核心序列,并与之结合,使被调节的基因激活或转录增强。 c-MYC重排后,导致 c-MYC编码的蛋白过度表达,从而影响一些涉及细胞周期调节、凋亡、细胞生长和分化、细胞代谢和细胞黏附的转录,涉及细胞生长的一些基因异常表达,导致细胞异常增生[ 4]。
本研究46例DLBCL患者中有4例发生 c-MYC重排,阳性率为8.7%,与文献报道一致[ 6, 7]。4例(20.0%)发生 c-MYC重排的DLBCL均为GCB类,26例non-GCB类DLBCL患者均没有发现 c-MYC重排,两者比较,差异有统计学意义( P<0.05)。但有研究指出GCB类和non-GCB类中发生 c-MYC重排的差异并没有统计学意义[ 7],可能和我们研究的病例数太少或种族上的差异有关。
国外研究发现,发生 c-MYC重排的患者Ki-67高表达[ 7],Ki-67为细胞增殖的一种标记,在细胞周期的G、S、G2和M期中表达,Ki-67阳性细胞比率反映了进入细胞周期的增生细胞比率,其高表达往往与肿瘤的预后不良相关。我们研究的4例 c-MYC重排患者Ki-67均高表达。
用利妥昔单抗、环磷酰胺、长春新碱、阿霉素和泼尼松方案(R-CHOP)化疗,发现 c-MYC重排阳性的DLBCL患者预后均比较差[ 6, 7, 8, 9],其阳性患者无进展生存期(PFS)显著差于阴性者,中枢复发风险高,生存率显著差于阴性者。由于 c-MYC重排阳性预后差,有人认为发生 c-MYC重排的DLBCL是一独特亚型[ 7]。部分GCB类的DLBCL患者预后比较差,可能与 c-MYC重排有关。
与其他恶性肿瘤一样,DLBCL的发生是复杂的、多步骤的过程。在这一过程中,往往涉及染色体易位、癌基因扩增重排、抑癌基因缺失或突变等各方面,如TP53缺失、BCL-6重排等[ 10, 11],多基因病变逐渐累积,最终形成恶性克隆。 c-MYC重排仅仅是部分DLBCL发病步骤中重要的一环。
FISH技术是将已知核酸序列作为探针,以荧光素直接标记或先以非放射性物质标记后与靶DNA进行杂交,再通过免疫细胞化学过程连接上荧光素标记物,最后在荧光显微镜下观察杂交信号,从而对标本中待测核酸进行定性、定位和定量分析的方法。该技术广泛应用于优生优育、血液病的研究。
为了研究DLBCL患者发生 c-MYC重排情况,我们把FISH技术运用于石蜡包埋组织切片上,该技术具有敏感性和特异性高、只需要较少组织、定位准确等优点。如果在肿瘤组织中,肿瘤细胞分布不均匀或肿瘤细胞间加杂有很多反应性增生成分时,可先根据HE切片定位富含有肿瘤细胞的区域做以标记,然后再与所需探针杂交,从而提高检测的正确性。总之,在石蜡包埋组织切片上进行的FISH技术,是简单易行的、经济的、可与组织形态学相结合的技术。我们可以预见FISH技术能在淋巴瘤的诊断、治疗、预后以及机制研究等方面发挥越来越大的作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|