通讯作者:赵虎,联系电话:021-62483180-20847。
作者简介:赵付菊,女,1985年生,硕士生,主要从事临床微生物学研究。
分析泛耐药鲍曼不动杆菌(PDRAB)的耐药性、同源性及感染病例的临床特征和治疗情况,为指导临床合理用药、控制感染提供依据。
方法收集临床分离自住院患者的鲍曼不动杆菌,用法国生物梅里埃VITEK-2 Compact全自动细菌分析仪及药敏纸片法分析菌株耐药性。选取PDRAB感染的病例,用回顾性统计分析方法分析PDRAB感染病例的临床特征及疗效转归;用微量板半定量法检测PDRAB 菌株的生物膜形成能力;用脉冲场凝胶电泳法分析PDRAB 菌株的同源性。
结果共收集鲍曼不动杆菌138株,其中PDRAB 菌株11株,占7.97%;选取PDRAB感染的病例10例,其中呼吸重症监护室7例(70%)、普外科2例(20%)、普通重症监护室1例(10%)。10株PDRAB对多黏菌素B敏感率为100%,对目前所有常规的抗菌药物耐药率为100%。138株鲍曼不动杆菌菌株中生物膜阳性7株(5.07%),其中PDRAB 2株、非PDRAB 5株。10株PDRAB 菌株共分为7型(A、B、C、D、E、F、G),其中D和E型中的2株菌株的同源性高,其余为散发株。
结论呼吸重症监护病房泛耐药现象严重,长期广谱抗菌药物的使用、侵入性诊疗,合并多种基础疾病与感染发生密切相关,多种抗菌药物联合使用对控制PDRAB 感染有一定疗效。PDRAB耐药机制复杂,应以呼吸重症监护室为防控重点,同时加强对生物膜阳性菌株所分布的病区的耐药性监测。
To investigate the drug resistance and homology of pandrug-resistant
The drug resistance of
A total of 138
Pandrug-resistance is serious in respiratory intensive care unit of the hospital. Pandrug-resistance is closely related to long-term use of broad-spectrum antibiotics,invasive treatment,and patients with multiple underlying diseases. A variety of antimicrobial agents used in combination use have a certain effect on the control of PDRAB infection. It is necessary to strengthen the monitoring of drug resistant and biofilm-positive isolates,especially in respiratory intensive care unit.
鲍曼不动杆菌是一种非发酵的革兰阴性杆菌,广泛存在于自然界和医院环境中,是导致医院感染最常见的条件致病菌之一[ 1],可引发呼吸机相关性肺炎、导管相关性血流感染、继发性脑膜炎、泌尿道感染及伤口感染等,其中以重症监护室患者感染发生率最高[ 2]。近年来,鲍曼不动杆菌对氨基糖苷类、喹诺酮类及广谱β-内酰胺类等抗菌药物产生多药耐药的现象日趋严重,尤其是泛耐药菌株的产生,使得临床抗感染治疗面临极大的挑战[ 1, 3]。 因此,了解鲍曼不动杆菌的耐药变化情况,避免感染相关的高危因素,合理选择现有的抗菌药物对预防和控制多重耐药和泛耐药的鲍曼不动杆菌菌株产生和传播至关重要。为此,我们收集分离自住院患者的138株鲍曼不动杆菌,其中有10例感染泛耐药鲍曼不动杆菌(PDRAB),对PDRAB的耐药性、感染患者的病史特点及治疗情况进行了分析。
收集复旦大学附属华东医院2011年9月1日至2012年7月31日分离自住院患者的鲍曼不动杆菌138株,其中PDRAB 11株。11株菌株中包括同一患者来源但不同时期分离的2株PDRAB,对感染PDRAB的10例临床病例进行回顾性调查。
细菌分离培养按《全国临床检验操作规程》(第3版)方法进行。菌株进行鉴定及药敏试验采用法国生物梅里埃公司VITEK-2 Compact全自动细菌分析仪,根据美国临床实验室标准化协会(CLSI)2012指导原则判读细菌耐药性。质控菌株铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922由卫生部临床检验中心提供。药敏纸片头孢曲松、头孢西丁、多黏菌素B纸片购自英国OXOID公司。
微量板半定量法参照Tomaras等[ 4]的实验方法。96孔板购自Grenier公司,结晶紫购自中国医药集团上海化学试剂公司。挑取平皿上单个菌落于LB 培养基中培养12 h (108 CFU/mL) ,用含0.25%葡萄糖的LB 培养基1∶200 稀释后加入96 孔培养板(200 μL/ 孔,3复孔) ,37 ℃静置培养24 h,弃菌液,PBS重复洗涤3次,后用99%甲醇固定15 min,弃甲醇室温干燥,加入2% 结晶紫染色8 min,水洗至无色,室温干燥后,每孔200 μL 95%乙醇脱色5 min,所得有色溶液用酶标仪测定570 nm吸光度( A)值。以 A值的平均值加3 倍标准差( s)作为标准评价生物膜形成的能力。试验重复3 次。强阳性: A值≥2.0,中等阳性:1.0< A值 <1 .9,阴性: A值≤0.9。
配制细胞悬浮液[100 mmol/L Tris∶100 mmol/L乙二胺四乙酸(EDTA)1∶1,pH值8.0],用灭菌棉签挑取平板上的细菌制成均匀的细菌悬液,调整细菌悬液的浓度到4麦氏单位。取200 μL细菌悬液和10 μL 20 mg/mL蛋白酶K混合,取50 ℃水浴中的1% Seaken Gold 琼脂糖凝胶200 μL 混匀制成胶块。胶块凝固后将其置于 5 mL的细胞裂解液与25 μL 20 mg/mL蛋白酶K混合液中,50 ℃轻振荡3 h。用水洗胶2次,TE缓冲液洗4次。最后将胶块置5 mL TE缓冲液中,4 ℃保存。切2 mm宽的胶块置于含30 μL ApaⅠ酶的酶切缓冲体系中,37 ℃酶切3 h。配制1% Seaken Gold 琼脂糖凝胶160 mL,置于54 ℃水浴中,将酶切后的胶块按序排列在样品梳对应位置,将琼脂糖缓慢倒入模具中,凝固后,拔出样品梳,将胶块置入电泳槽中。电泳条件:电压6 V/cm,电泳时间16 h,脉冲参数0.22~18 S、120°,电泳温度14 ℃。电泳结束后,Gelred 染色,用荧光成像仪读胶分析。
运用WHONET 5软件和SPSS17.0进行数据分析。抗菌药物种类与疗效的相关性分析采用两独立样本秩和检验;用四格表资料Fisher精确概率法对菌株生物膜形成阳性率进行比较, P<0.05表示差异有统计学意义。
10例患者中呼吸重症监护室(RICU)7例、普外科2例、重症监护室(ICU)1例。检出标本以痰标本为主,共8例,胆汁标本1例,中心静脉导管标本1例。主要病症为恶性肿瘤、肺炎。患者主要为高龄患者,平均年龄为85岁。发生PDRAB感染前平均住院天数178 d,抗菌药物治疗后6例好转,3例死亡,1例治愈,见 表1。
| 表1 10例感染PDRAB的患者的临床资料信息(例) |
10例患者均有慢性病史,合并3种及以上疾病的患者有7例(70%)。均采用机械通气、静脉置管(占100%);采用引流管9例(90%);手术6例(60%)。10例患者在感染PDRAB前均有抗菌药物使用史(100%)。PDRAB感染主要发生于长期住院的高龄危重病患者,多合并糖尿病及心脑血管疾病,有机械通气、导管留置、手术及抗菌药物治疗史,采用多种药物联合治疗效果好。
10例患者在发生PDRAB感染前均已接受过抗菌药物治疗,以应用碳青霉烯类和单环β-内酰胺类抗菌药物为主,分别为9例和6例,平均使用天数分别为15.7 d和14.3 d;其次为3代以上头孢类和抗真菌类,均为5例,平均使用天数均较长,分别为17.8 d和21.8 d;应用喹诺酮类为4例,平均使用天数为12.25 d。
10例感染PDRAB患者经治疗后总有效(治愈+好转)率为60%,1例病情无明显变化,使用一种药物治疗6 d后出院,3例恶化,均因感染加重原发病而死亡。抗菌药物联合应用种类数目,好转组平均为5.5种,平均使用天数19.2 d;恶化组平均为3.7种,平均使用天数为9.1 d。
10株PDRAB对目前所有常规抗菌药物耐药率为100%,对多黏菌素B敏感率为100%。
138株鲍曼不动杆菌中有7例生物膜形成能力检测阳性,检出率为5.07%;其中2株为PDRAB菌株、5株为非PDRAB菌株。PDRAB生物膜检出率为20%,非PDRAB生物膜检出率为3.9%。2株PDRAB与5非PDRAB的耐药性比较见 表2、 表3。
| 表2 微量板半定量法检测鲍曼不动杆菌的生物膜形成情况[株(%)] |
| 表3 2株生物膜阳性PDRAB与其他5株生物膜阳性非PDRAB对常见抗菌药物的耐药性比较(例) |
鲍曼不动杆菌作为一种条件致病菌,可定植于人体皮肤、伤口、呼吸道和胃肠道,对外界环境适应力极强,能在医院干燥物体表面长期存活。多重耐药鲍曼不动杆菌已经在全球各地广泛流行,甚至造成医院感染的爆发流行[ 5],且耐药率仍不断增加[ 6],有关世界各地的泛耐药菌株感染的报道也频频出现[ 1]。复旦大学附属华东医院2011年9月~2012年7月期间PDRAB占该菌总株数率为7.97%,与孙树梅等[ 7]报道基本一致。PDRAB菌株主要来自痰标本,分布科室以RICU为主。10例病例中90%为70岁以上的高龄患者,以晚期肿瘤患者及反复发生吸入性肺炎的长期卧床患者为主,同时多合并糖尿病及其他慢性呼吸系统、心脑血管系统疾病;90%以上的患者在感染泛耐药菌株前接受过呼吸机辅助通气、导管留置和多种抗菌药物的治疗,其中碳青霉烯类使用率最高,与Manikal等[ 8]的研究一致。
鲍曼不动杆菌可以通过产生β-内酰胺酶、改变细胞膜的通透性、主动外排泵、改变药物作用靶点和形成生物膜等机制对抗菌药物产生耐药[ 1, 9, 10, 11, 12]。某些能形成生物膜的鲍曼不动杆菌,更易在医院环境中长期存活[ 13],临床危害更大。本研究138株鲍曼不动杆菌中生物膜阳性7株,其中PDRAB菌株2株、非PDRAB菌株5株,对这2组生物膜阳性的菌株进行统计学分析,差异无统计学意义( P=0.082),得出生物膜与菌株的耐药可能为2个独立的耐药机制。2株生物膜阳性的PDRAB菌株来自RICU,必须采取包括隔离患者、专人护理、对患者尽量使用专用的医疗设备和物品的综合性感染防控措施。对5株生物膜阳性的非泛耐药菌株所在的病区也应采取适当防控措施,从而避免新的泛耐药且生物膜阳性的菌株出现和传播。
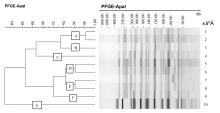
临床分离的耐药菌株的分子流行病学调查对分析菌株间相关性,追踪传染源和传播途径,有效控制医院感染意义重大。PFGE具有分辨率高、重复性好、分型力强的特点,为细菌同源性分析的金标准。本研究10株PDRAB菌株分7种类型,2011年9~12月分离的4例PDRAB菌株中分为D和E型,均分离自同一病区且体外药敏试验完全一致,提示此期间有发生交叉感染的可能;2012年1~7月检出的PDRAB菌株型无明显同源性。值得注意的是,有2株PDRAB菌株来源同一患者不同时期(时间间隔17 d),其同源性明显不一致;其中1株具有生物膜形成能力,提示患者感染了新的泛耐药菌株。因此,出现同一患者多次分离到PDRAB,不一定为定植菌,需要结合病情变化和治疗效果及其他方法等排除感染新的泛耐药菌的可能。PFGE结果显示2011年9月8日分离自普外科的1株PDRAB菌株与2012年2月6日分离自RICU的非PDRAB同源性一致,但基于临床没有交叉感染的危险因素存在,体外药物敏感试验不一致,且PFGE 得到的亲缘关系并非真正意义上的种系发生情形[ 14],故判定为两菌株来源不同。建议在应用PFGE分析同源性的同时还需结合流行病学调查结果和其他分子分型资料才能最终确定疾病的传染源。
鲍曼不动杆菌在短短几十年内成为医院感染的最重要病原菌之一,已成为我国重症监护病房检出率最高的病原菌[ 15]。鲍曼不动杆菌虽然致病力较弱,但耐药性较强,尤其是对泛耐药的菌株使临床医生陷入无药可用的困境。因此,开展研发新的抗菌药物治疗同时,应加强细菌耐药监测,严格把握抗菌药物治疗指针,加强消毒隔离,从而有效控制预防耐药菌株的爆发流行,改善耐药现状。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|