通讯作者:胡志东,联系电话:022-60814186。
作者简介:王立新,女,1975年生,学士,主管技师,主要从事细菌耐药机制研究。
了解2006年1月至2011年8月临床血流感染患者红霉素耐药金黄色葡萄球菌红霉素核糖体甲基化酶(
收集2006年1月至2011年8月引起血流感染的39株红霉素耐药金黄色葡萄球菌。应用VITEK 2 Compact全自动细菌鉴定仪及配套鉴定卡、药物敏感性卡对细菌进行鉴定及药物敏感性试验。头孢西丁纸片扩散法筛选耐甲氧西林金黄色葡萄球菌(MRSA),并以D试验测定红霉素对克林霉素的诱导耐药表型。聚合酶链反应(PCR)分别检测
39株红霉素耐药金黄色葡萄球菌对克林霉素、青霉素、庆大霉素的耐药率高,分别为100.0%、92.3%、53.8%。8株(20.5%)红霉素耐药而克林霉素敏感株D试验全部为阳性结果。
在引起血流感染的红霉素耐药金黄色葡萄球菌中
To investigate the distribution and epidemic situation of erythromycin ribosome methylase(
A total of 39 isolates of erythromycin-resistant
The resistant rates of 39 erythromycin-resistant
The positive rate of
金黄色葡萄球菌是引起医院和社区感染的主要病原体,其感染有较高的发病率和死亡率[ 1]。金黄色葡萄球菌可以引起多种感染,由其引起的血流感染由于发生率高、预后差而备受关注。对多耐药株,特别是耐甲氧西林金黄色葡萄球菌(MRSA)引起的感染已成为抗感染治疗中的一个难题。MRSA可同时对β-内酰胺类、酶抑制剂复合抗菌药物及碳青霉烯类药物耐药,因此临床医生在治疗由其引起的感染时常使用大环内酯类(macrolide )、林可酰胺类( lincosamide )和B 类链阳霉素类( streptogramin type B )奎奴普丁[ 2],但目前的研究显示引起血流感染的金黄色葡萄球菌已对红霉素、克林霉素有较高的耐药率[ 3]。本研究对2006至2011年临床分离的39株引起血流感染的红霉素耐药金黄色葡萄球菌进行红霉素核糖体甲基化酶( erm)基因检测,并进行同源性分析,以了解耐药基因的分布及其流行情况。
1. 菌株来源 收集2006年1月至2011年8月自临床分离的39株引起血流感染的红霉素耐药金黄色葡萄球菌,剔除同一患者重复分离菌株,标本主要来源于感染科、肾科、重症监护病房(ICU)、血液科等临床科室。全部菌株经VITEK 2 Compact全自动细菌鉴定仪鉴定。质控菌株为金黄色葡萄球菌(ATCC 25923)。
2. 试剂与仪器 VITEK 2 Compact全自动细菌鉴定仪(法国生物梅里埃公司),9700型基因扩增仪(美国 Perkin Elmer 公司),电泳仪(北京市六一仪器厂),凝胶成像仪、CHEF Ⅲ型脉冲电泳仪(美国Bio-Rad公司),红霉素(15 μg)、克林霉素(2 μg)纸片和其他药物敏感性纸片(北京天坛公司),聚合酶链反应(PCR)试剂、DNA Maker和限制性内切酶SmaI[宝生物工程(大连)有限公司],溶葡萄球菌素(意大利BBI公司)。
1. 细菌鉴定及药物敏感性试验 应用VITEK 2 Compact全自动细菌鉴定仪及配套鉴定卡、药物敏感性卡对细菌进行鉴定及药物敏感性试验。药物敏感性试验结果解释标准按照美国临床实验室标准化协会(CLSI)指南(2010年版)[ 4]进行。头孢西丁纸片扩散法筛选MRSA。
2. D试验测定红霉素对克林霉素的诱导耐药表型 D试验操作按CLSI指南(2010年版)[ 4]进行。
3. erm基因的检测 煮沸法制备DNA模板,25 μL反应体系,引物序列和PCR反应条件参考文献[5],见 表1。PCR产物进行1.5%琼脂糖凝胶电泳分析,主要PCR阳性产物测序结果与GenBank 数据库进行比对。
| 表1 用于 erm基因检测的引物序列及反应条件 |
4.脉冲场凝胶电泳(PFGE)分型 参考Goering等[ 6]PFGE方法,略加改动。制备完成的小胶经30 U 限制性内切酶Sma I在30 ℃ 酶切4 h后放入电泳槽,电泳温度14 ℃,电泳时间18 h,电泳方向角度变换120°,电压6 V/cm,线性梯度变化4~40 s。电泳结束后,将胶放入含0.5 μg/mL的溴化乙啶(EB)中染色30~40 min,放入凝胶成像系统成像。结果判读按美国疾病预防控制中心(CDC) Tenover等[ 7]推荐的方法判读:图谱完全相同的定义为一个型;彼此之间相差1个条带的定义为同一型的不同亚型;相差2~3个条带的认为亲缘关系密切;相差4~6个条带的认为可能相关;条带相差7个以上的则认为无亲缘关系。随机选择不同字母,如A、B、C、D等的字母顺序分型。
5.葡萄球菌染色体mec(SCCmec)分型 按Zhang等[ 8]介绍的多重PCR进行SCCmec分型。反应体系为25 μL,共9对引物。反应条件:94 ℃预变性5 min,然后94 ℃变性45 s,65 ℃退火45 s,72 ℃延伸90 s,10个循环,随后94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,循环25次,最后72 ℃延伸10 min。电泳结果用凝胶成像系统观察。
39株红霉素耐药金黄色葡萄球菌中有8株为红霉素耐药而克林霉素敏感,D试验全部为阳性,为诱导性耐药,阳性率20.5%。31株为结构性耐药,见 图1。 10株金黄色葡萄球菌对头孢西丁的抑菌圈直径≤21 mm,判定为MRSA。
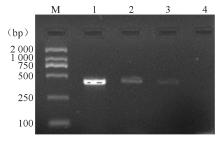
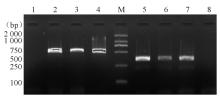
39株红霉素耐药金黄色葡萄球菌中 erm基因的携带率为100.00%,检出 ermA基因10株(25.6%)、 ermB基因18株(46.2%)、 ermC基因18株(46.2%),其中同时携带 ermA和 ermC基因7株(17.9%)。红霉素对克林霉素诱导耐药株 ermC基因携带率为75.0%(6/8), ermA基因携带率为25.0%(2/8)。主要PCR产物部分测序结果经GenBank比对证实, ermA、 ermB、 ermC(登录号依次为:AF466413、HQ683763、Y09002)同源性均为99%。电泳结果见 图2、 图3。
39株红霉素耐药金黄色葡萄球菌对克林霉素、青霉素、庆大霉素的耐药率高,分别为100.0%、92.3%、53.8%,携带 ermA/A+C、 ermB和单独携带 ermC株的耐药率见 表3。
| 表3 携带不同 erm基因的金黄色葡萄球菌对抗菌药物的耐药率(%) |
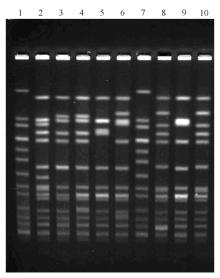
10株携带 ermA基因的MRSA共分为6型,分别为A型 (2 株)、B型 (1 株)、C型 (2株)、D型 (1 株)、E型 (2 株)、F型 (2 株)。见 图4。
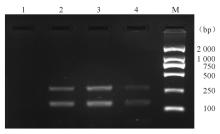
10株携带 ermA基因的MRSA中,8株为SCCmecⅢ型,2株未能分型。见 图5。
金黄色葡萄球菌是临床常见的病原菌。目前临床分离自血流感染的金黄色葡萄球菌对红霉素和克林霉素的耐药率均>50.0%[ 3]。金黄色葡萄球菌对大环内酯类如红霉素、林可酰胺类如克林霉素和B 类链阳霉素类抗菌药物的耐药机制有能量依赖的主动泵出和核糖体靶位改变2种。前者由 msrA、 msrB 基因编码,对大环内酯及链阳霉素类耐药,后者与 erm基因相关,由 erm基因编码产生的erm导致23S rRNA 的甲基化作用,降低了大环内酯类、林可酰胺类和B类链阳霉素抗菌药物对核糖体的结合从而产生耐药。由 erm基因介导的耐药可以是诱导型和结构型2种。诱导型通常的耐药表型是红霉素耐药但克林霉素敏感,必须进行D试验才能检测出来[ 9],结构型通常的耐药表型是红霉素和克林霉素均耐药[ 2]。
本研究结果显示,39株分离自血流感染患者的红霉素耐药金黄色葡萄球菌全部携带 erm基因。携带 ermA基因的菌株均为MRSA,多表现为多药耐药,单独携带 ermA和同时携带 ermA、 ermC的金黄色葡萄球菌对多种药物的耐药率明显高于携带 ermB和单独携带 ermC的菌株。携带 ermB基因的菌株全部为MSSA(62.1%,18/29),同时 ermB基因也是引起分离自血流感染金黄色葡萄球菌结构性耐药的主要基因(58.1%,18/31),本研究中 ermB的检出率明显高于先前的研究[ 2, 10],可能存在地区性差异,也可能与标本来源有关,有待进一步研究。8株红霉素对克林霉素诱导耐药株中6株携带 ermC基因(75.0%,6/8),2株携带 ermA基因(25.0%,2/8),未检出 ermB基因,本结果与沈定霞等[ 2]的研究结果一致,表明 ermC基因是引起诱导性耐药的主要机制。
SCCmec分型显示10株携带 ermA基因的MRSA其中8株为SCCmecⅢ型(2株未能分型),表明引起血流感染的红霉素耐药的MRSA主要为SCCmecⅢ型。这与陈荣等[ 11]的研究结果一致。PFGE分型结果显示10株MRSA共分为6型,部分菌株具有高度的同源性,同时某些型别之间亲缘关系密切,此类菌株分布于同一病房或不同病房,提示携带 ermA 基因的金黄色葡萄球菌引起的医院感染存在病房内部和病房之间的散发克隆传播。
本研究结果表明, erm基因在引起血流感染的红霉素耐药金黄色葡萄球菌中分布广泛,是引起大环内酯类、林可酰胺类和B类链阳霉素抗菌药物耐药的主要机制,同时由于MRSA均携带 ermA基因,并存在散在克隆传播现象,故应加强医务人员生物安全观念以及病区的消毒隔离意识,切断病原菌传播途径,防止引起临床感染的金黄色葡萄球菌在院内引起进一步传播流行。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|