作者简介:洪岭,男,1978年生,博士,主治医师,主要从事生殖内分泌、妇产科学研究。
通讯作者:陈信良,联系电话:021-64070434。
研究肿瘤坏死因子α(TNF-α)对猪卵泡内膜睾酮分泌及细胞增殖情况的影响,探讨TNF-α在多囊卵巢综合征(PCOS)发病机制中的作用。
方法在体外培养的猪卵泡内膜细胞培养液中加入TNF-α(10、100和1 000 pg/mL),采用放射免疫分析法(RIA)观察细胞上清液中睾酮浓度的变化,CFDA SE细胞增殖检测试剂盒和流式细胞仪观察TNF-α对卵泡内膜细胞增殖情况的影响。
结果在体外培养的卵泡内膜细胞培养液中加入TNF-α后,在24、48和72 h 3个时间点分别与空白对照组(TNF-α 0 pg/mL)相比,睾酮水平未见明显变化; 72 h后TNF-α(100和1 000 pg/mL)组卵泡内膜细胞平均荧光强度(MFI)明显低于对照组(分别为53.2±11.59和66.87±14.8,
TNF-α没有直接促进睾酮分泌的作用,但却具有促进卵泡内膜细胞增殖的功能,这个功能可能与PCOS患者发生卵巢白膜增厚、卵泡内膜细胞增生病变有关。
To study the influence of tumor necrosis factor-alpha (TNF-α) on the secretion of testosterone and the proliferation in theca interna cells,and to investigate the role of TNF-α in the pathogenesis of polycystic ovary syndrome (PCOS).
MethodsDifferent concentrations of TNF-α(10,100 and 1 000 pg/mL) were treated with theca interna cells. The secretion of testosterone in theca interna cells were detected by radioimmunoassay (RIA),and the proliferation of theca interna cells were detected by CFDA SE kit and flow cytometry.
ResultsThe testosterone level had no difference among the groups(10,100 and 1 000 pg/mL)and the control group(0 pg/mL)at 24 h,48 h and 72 h in theca interna cells. After 72 h,the mean fluorescence intensities (MFI) in theca interna cells with TNF-α 100 pg/mL and 1 000 pg/mL were obviously lower than those in the control group (53.2±11.59 and 66.87±14.8,
Although TNF-α does not affect the secretion of testosterone,it can promote the proliferation of theca interna cells. This function may explain that PCOS usually accompanies thick ovarian tunica albuginea and proliferative theca cells.
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是以性腺轴失调为主的一个复杂的全身性神经-内分泌-代谢网络失控的症候群,其发病机制至今不是十分清楚。目前认为PCOS的发病机制与以下因素有关:肾上腺功能初现亢进、下丘脑神经内分泌功能异常、胰岛素样生长因子异常、胰岛素抵抗、遗传因素等,但任何单一学说都难以全面解释PCOS的所有临床表现和生化、病理改变,PCOS已成为当今妇科内分泌领域的一个研究热点和最复杂难点。近几年,国内外许多文献报道PCOS患者体内的许多炎症因子,如肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、白细胞介素6(IL-6)等水平高于正常人群,PCOS的发生、发展与炎症因子具有密切关系[ 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12]。PCOS类似糖尿病、动脉粥样硬化等,可能也是一种炎症性疾病。这里的炎症不同于有红、肿、热、痛、发热等表现的急性炎症,而是由人体免疫系统介导的一种慢性、低度的非特异性的亚临床炎症状态或促炎症状态(proinflammatory state),患者体内的许多炎症因子水平高于正常人群。有学者指出这种慢性,低度亚临床炎症(炎症学说)可能也是PCOS的发病机制之一。那么炎症因子引发PCOS的机制是什么?本研究将通过体外培养的卵泡内膜细胞进一步探讨TNF-α与PCOS发病机制的关系。
猪重组TNF-α(prospec),DMEM/F12(1∶1)培养液(Hyclone),胶原酶Ⅱ(TBD),透明质酸酶(Sigma),胰蛋白酶(Sigma),胎牛血清 (FBS,杭州四季青),CFDA SE细胞增殖与示踪检测试剂盒 (碧云天生物技术研究所),36%乙酸溶液(上海化学试剂公司),睾酮放射免疫测定试剂盒(北京北方生物技术研究所)。CO2细胞培养箱(HEPA CLASS 100),倒置荧光显微镜(TE2000-U,Nikon Eclipse),流式细胞仪(BD FACSCalibur),γ放射免疫计数器(Gc-911,安徽合肥中国科大中佳公司)。
取新鲜的猪卵巢,置于放有双抗的冰生理盐水中(青霉素、链霉素各含80万IU/500 mL生理盐水),冰盒内保存,于2 h内进行试验。试验时用生理盐水反复冲洗,将卵巢放入平皿中,选取直径约4~6 mm的健康卵泡,在解剖显微镜下用显微解剖剪小心将卵泡对半剪开,使草黄色卵泡液流出,用自制刮匙仔细刮除附着在其表面的颗粒细胞,用显微镊剥离出卵泡内膜(呈帽状),并用生理盐水反复冲洗数次。将卵泡内膜剪碎,加入酶液[0.25%胶原酶Ⅱ、0.05%透明质酸酶、0.05%胰蛋白酶],置于37 ℃含5%CO2的培养箱内消化20~50 min,期间每隔10 min用移液管反复吹打以利于卵泡内膜的消化,以适量含血清的培养基终止消化后,以100目不锈钢滤网滤过。以200× g离心5 min,除去酶,生理盐水洗1次。将获取的卵泡内膜细胞悬浮于含10%FBS的DMEM/F12培养基(含1%双抗)内,0.04%台盼兰染色显示活力(>70%),待用。
采用放射免疫分析法(radioimmunoassay,RIA)测定24孔培养板中细胞上清液的睾酮浓度,按照试剂盒说明书,依次加入标准品和样品50 μL、125I标记的睾酮100 μL及睾酮抗体100 μL,充分混合;37 ℃孵育1 h;加入沉淀剂0.5 mL,室温放置15 min,1 200× g离心15 min;弃去上清,沥干试管,γ记数器检测。
CFDA SE的全称为Carboxyfluorescein diacetate, succinimidyl ester,分子式为C29H19NO11,相对分子质量为557.47,CAS号码为150347-59-4。CFDA SE可以通透细胞膜,进入细胞后可以被细胞内的酯酶(esterase)催化分解成羟基荧光素乙酰乙酸(CFSE),CFSE可以偶发性地并不可逆地和细胞内蛋白的Lysine残基或其他氨基发生结合反应,并标记这些蛋白。在加入荧光探针CFDA SE后大约24 h即可充分标记细胞。被CFDA SE标记的非分裂细胞的荧光非常稳定,稳定标记的时间可达数月。CFDA SE标记细胞的荧光非常均一,比以前使用的其他细胞示踪荧光探针如PKH26的荧光更加均一,并且分裂后的子代细胞的荧光分配也更均匀。由于CFDA SE标记细胞的荧光非常均匀和稳定,每分裂1次,子代细胞的荧光会减弱一半,这样通过流式细胞仪检测就可以检测出没有分裂的细胞、分裂1次的细胞(1/2的荧光强度)、分裂2次的细胞(1/4的荧光强度)、分裂3次的细胞(1/8的荧光强度)以及类似的其他分裂次数的细胞。使用CFDA SE可以检测分裂多达8次或更多次数的细胞增殖。
CFDA SE标记细胞后通常用流式细胞仪进行细胞增殖检测,CFDA SE标记细胞呈绿色荧光,检测时的激发波长可以选择488 nm,此时的发射波长为518 nm,使用流式细胞仪检测时可以采用FL1 detection channel。CFDA SE标记的细胞也可以用荧光显微镜进行观察。CFDA SE标记的细胞无论在体外还是体内都不会使邻近细胞染色。即CFDA SE荧光探针完成标记后不会从一个细胞转移到邻近细胞。
将猪卵泡内膜细胞按照CFDA检测试剂盒的说明书完成CFDA标记,用DMEM/F12培养液稀释成1×105/mL细胞悬液,按每孔1 mL加入到24孔培养板中,加入TNF-α,使其终浓度分别为0、10、100和1 000 pg/mL,0 pg/mL为对照组,每种浓度梯度均做3复孔。置37 ℃ 5%CO2培养箱培养48 h后换液,换液72 h后用流式细胞仪检测细胞增殖情况。
常规胰酶消化、DMEM/F12培养液中和胰酶后,从24孔培养板中将每组细胞转移到流式管中,200× g离心5 min,然后用磷酸盐缓冲液(PBS)再洗涤1次,用PBS稀释到适宜浓度后上机检测。
流式细胞仪(BD FACSCalibur)检测:光源488 nm的氢离子激光,上机前先用标准微球调整仪器,使变异系数在2%以内,上机后收集10 000个细胞,荧光强度以对数放大,光散射数据存硬盘,用FlowJo软件分析每组细胞的平均荧光强度。
所有数据采用SPSS 16.0统计软件进行统计分析,数据以 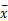
TNF-α浓度为10、 100和1 000 pg/mL 3个试验组,在24、48和72 h 3个时间点分别与空白对照组(不加药组,TNF-α浓度0 pg/mL)相比,每个浓度做3复孔,重复3次。结果显示,在加入TNF-α后,24、48和72 h 3个时间点分别与空白对照组比较,睾酮水平未见明显变化,见 表1。
| 表1 TNF-α刺激下卵泡内膜细胞所分泌的睾酮与对照组的比较(ng/mL) |
在TNF-α (100和1 000 pg/mL)刺激72 h后,卵泡内膜细胞的平均荧光强度(MFI)与空白对照组 (TNF-α 0 pg/mL)相比明显降低(分别为53.2±11.59和66.87±14.8, P=0.013; 47.55±7.31和66.87±14.8, P=0.001);而TNF-α (10 pg/mL)与空白对照组(TNF-α 0 pg/mL)相比,没有出现明显变化(60.2±9.20和66.87±14.8, P=0.211)。
1985年Shalaby把巨噬细胞产生的TNF命名为TNF-α,把T淋巴细胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β,两者生物学作用极为相似。人的TNF-α基因长约2.76 kb,相对分子质量为17 000。TNF-α来源包括各种免疫细胞、内皮细胞、成纤维细胞、表皮细胞和平滑肌细胞等,其中活化的单核巨噬细胞是其主要来源。TNF-α具有广泛的生物学活性,如杀伤或抑制肿瘤细胞;提高中性粒细胞的吞噬能力,增强抗体依赖细胞介导的细胞毒反应(ADCC)功能;抗感染;引起发热,并诱导肝细胞急性期蛋白的合成;抑制病毒的复制;在调节机体组织糖、脂肪代谢中也起重要作用。
杨雪峰等[ 13]报道无论是PCOS伴肥胖组,还是体重正常PCOS组血浆TNF-α水平均高于正常对照人群。Peral等[ 14]报道,肿瘤坏死因子受体Ⅱ基因(the tumour necrosis factor receptor superfamily 1B gene, TNFRSF1 B)与PCOS发病有关。第6外显子部位的M196R(676T→G)变异与其第4内含子CA微卫星重复多态性呈连锁不平衡,M196R出现频率在PCOS组(30.3%)和对照组(15.3%)妇女中比较,差异有统计学意义( P<0.05);该结果显示, TNFRSF1 B第6外显子M196R多态性与PCOS和高雄激素血症密切相关。
典型的PCOS卵巢组织形态学上会发生如下变化:卵巢双侧硬化性多囊改变,卵巢被膜呈纤维化或胶原化增厚,表面饱满、光滑,呈珍珠白色,体积较正常卵巢增大23倍,切面可见卵巢的白膜均匀增厚,皮质区增宽,被膜下有多个直径29 mm囊状卵泡或较大储留卵泡囊肿,罕见黄体或白体,卵巢的髓质区增厚,伴有水肿。镜下显示,卵巢的白膜组织呈弥漫性增厚,较正常厚34倍,均由胶原化的纤维组织所组成。白膜下有许多不同成熟阶段的卵泡及闭锁的卵泡存在,卵泡内颗粒细胞少而稀疏,卵泡膜细胞增生,卵巢间质有时黄素化,但卵泡无排卵迹象。
本研究发现,在体外培养的卵泡内膜细胞中加入炎症因子TNF-α后,睾酮分泌没有明显变化,但卵泡内膜细胞的增殖能力却加强,说明TNF-α具有促进卵泡内膜细胞增殖的作用,这个功能可能与PCOS患者发生卵巢白膜增厚、卵泡内膜细胞增生病变有关。TNF-α引起细胞增殖的机制与激活如Jun氨基末端激酶(JNK)等信号转导通路有关[ 15];TNF-α还可引起胰岛素抵抗(IR)[ 2],继而由IR参与PCOS的发生。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|

