作者简介:张国明,男,1980年生,学士,主管技师,主要从事临床生物化学和分子生物学诊断研究。
探讨晚期非小细胞肺癌(NSCLC)化疗前、后血清细胞角蛋白19片段(CYFRA21-1)变化在疗效监测中的价值。
方法用化学发光免疫分析法对66例晚期NSCLC患者化疗前、后和30名健康对照者血清CYFRA21-1含量进行测定,分析不同疗效患者血清CYFRA21-1含量变化差异。
结果在进行一线药物化疗前,NSCLC患者血清CYFRA21-1水平明显高于健康对照组(
血清CYFRA21-1在监测肺癌化疗患者病情、判断化疗效果中具有确切的价值。
To investigate the significance of serum cytokeratin 19 fragment 21-1 (CYFRA21-1) changes before and after chemotherapy in monitoring the therapeutic efficacy of advanced stage non small cell lung cancer (NSCLC).
MethodsThe serum CYFRA21-1 levels of 66 patients with advanced stage NSCLC before and after chemotherapy and 30 healthy controls were measured by chemiluminescence immunoassay,and the change differences of serum CYFRA21-1 in the patients with different therapeutic efficacy were analyzed.
ResultsCompared to those in the controls,serum CYFRA21-1 levels were significantly higher than those in patients before the first-line chemotherapy(
Serum CYFRA21-1 is exactly valuable in monitoring the pathogenetic condition and judging the chemotherapy efficacy of the patients with lung cancer.
正常人群血清细胞角蛋白19片段(cyto-keratin 19 fragment 21-1,CYFRA21-1)水平低于1.7 μg/L,当癌细胞溶解或坏死脱落时,可释放大量CYFRA21-1进入血循环使其表达上调。有研究表明,CYFRA21-1水平在恶性疾病中上升,特别是非小细胞肺癌(NSCLC)[ 1]。本研究检测了健康人以及NSCLC患者血清CYFRA21-1水平,并探讨其在NSCLC患者病情和化疗疗效监测中的价值。
选择沭阳县人民医院2009年5月至2011年9月收治的66例初诊的NSCLC患者,年龄45~72岁。原发肿瘤灶为可测量病灶[即胸片或普通计算机断层扫描(CT)肿瘤病灶最长直径≥2 cm,螺旋CT病灶直径≥1 cm]。所有患者经病理学证实为NSCLC,男37例,女29例,其中肺腺癌31例,肺鳞癌35例,根据1997年国际抗癌联盟(UICC)分期,ⅢA期6例,ⅢB28例,Ⅳ期32例。30名健康对照者为沭阳县人民医院体检中心体检健康者,男、女各15名,年龄29~76岁。健康对照组与肺癌组在年龄和性别上均有可比性,所有病例均符合以下条件:(1)均失去手术机会或不愿接受手术或有手术禁忌症的中晚期NSCLC;(2)患者之前未接受过其他抗肿瘤治疗;(3)具有可评价的肿瘤病灶,可行化疗疗效评价;(4)排除肺癌患者合并胃肠道疾病、妇科疾病、泌尿系统疾病、肾功能不全等疾病。
1.化疗方案
所有患者均接受一线化疗药物化疗,化疗方案: 吉西他滨+顺铂,吉西他滨1 000 mg/(m2·d),静脉滴注,第1、8、15天;顺铂100 mg/m2,静脉滴注,第1天。每4周为1疗程,并完成4个疗程。所有患者抽血当天如果用药,于抽血后滴注化疗药物。
2. 标本采集
于化疗第1疗程的当天上年8点、第8天上午8点、第15天上午8点以及第2疗程第1天上午8点、第3疗程的第1天上午8点和第3疗程最后1天采血(化疗周期为28 d),置促凝管5 mL,3 100× g离心15 min分离血清,-70 ℃贮存待检。化疗的第1、第2、第3疗程前血清CYFRA21-1基线水平定义为BV1、BV2和BV3,第1疗程的第8天上午8点、第15天上午8点血清CYFRA21-1水平定义为B1V8、B1V15。
3. 疗效评价标准
于第3疗程化疗前按1981年世界卫生组织(WHO)标准进行化疗疗效评价,疗效分4个等级:完全缓解(CR),指肿块缩小≥50%;缓解(PR),指肿块缩小≥25%,但<50%;无变化(NC)或稳定(S),指肿块缩小<25%或增大<25%;进展(P),指肿块增大>25%或出现新的病变。以上均于4周后CT复核证实。
4.分组
按CT评价化疗疗效分2组:缓解组(CR+PR)和无效组[NC(或S)+P]。66例NSCLC患者按1981年WHO标准以CT评价化疗效果:缓解53%(35/66);无效47%[NC占48.4%(15/31),P占51.6%(16/31)]。
5.CYFRA21-1检测
所有血清标本于美国贝克曼UniCelTM DxI800全自动免疫分析仪上进行测定,试剂为原厂配套试剂及质控物,严格按照说明书操作。CYFRA21-1参考范围为≤3.3 μg/L。
所有数据用SPSS 15.0软件包进行统计学处理,计量资料数据以 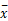
NSCLC患者血清CYFRA21-1水平明显高于健康对照组,差异有统计学意义( P<0.05)。在NSCLC患者中肺鳞癌患者CYFRA21-1水平和阳性率明显高于肺腺癌患者( P<0.05),见 表1。
表1 不同组织类型NSCLC患者和健康对照者血清CYFRA21-1水平比较(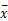 ±s) ±s) |
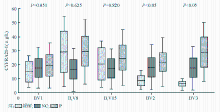
与治疗前比较,化疗缓解的患者治疗后CYFRA21-1水平明显下降( P<0.05),见 表2;单变量分析表明,缓解组第2疗程开始前的BV2、第3疗程开始前的BV3血清CYFRA21-1水平明显低于无效组( P<0.05),见 图1。BV1与BV2的差别(BV1-BV2)和BV1与BV3的差别(BV1-BV3),即疗程2和疗程3开始前的基线值分别较疗程1开始前下降幅度明显高于无效组( P<0.05)。
| 表2 NSCLC患者一线化疗缓解组和无效组血清CYFRA21-1水平(μg/L) |
NSCLC在一线化疗前血清CYFRA21-1水平BV1、B1V8、 B1V15在缓解组与无效组间差异均无统计学意义( P=0.051; P=0.625; P=0.820),但BV2和BV3差异有统计学意义( P<0.05);化疗后缓解组BV2和BV3与化疗前相比有逐渐降低的趋势( P<0.05)。缓解组化疗第2疗程前BV2与化疗第1疗程前BV1比较明显降低,提示此组NSCLC患者对化疗药物敏感。
NSCLC是肺癌中最常见的组织类型,占肺癌总数的70%~80%,各期肺癌的5年存活率只有13%,因此,肺癌的治疗和预后监测具有重要的意义。众所周知,化疗药物在杀伤肿瘤细胞的同时也伤害正常细胞,而初治NSCLC患者的化疗有效率仅为30%~40%[ 1]。因此,及时准确地判断疗效,终止无效治疗就显得尤为重要。然而影像学方法判断疗效多半在化疗几个周期后,因此,每周期化疗疗效的判断需依据患者的其他信息,如症状、体征和肿瘤标志物的变化等,而肿瘤标志物的变化最为重要。若能较早知道肿瘤对化疗的敏感性可根据患者的具体情况及时调整治疗方案,以达到个体化治疗的目的。
CYFRA21-1是细胞角蛋白19的可溶性片段,是一种酸性多肽,分布单层上皮细胞中,来源于上皮细胞的恶性肿瘤可见细胞角蛋白19的过度表达,NSCLC中鳞癌、腺癌均有细胞角蛋白19表达,当肿瘤细胞死亡时激活的蛋白酶加速了细胞角蛋白的降解,大量溶解的片段释放到血循环中[ 2],使血中CYFRA21-1含量升高,肺癌中CYFRA21-1含量特别丰富,尤其是鳞癌[ 3]。以往较多的研究将肿瘤标志物用于“诊断”,而国内外具有指导意义的文件都认为:肿瘤标志物的主要临床应用价值是判断治疗效果和复发监测[ 4],而少见国内将CYFRA21-1用于肺癌患者评价疗效的文献。本研究对象为晚期NSCLC患者,化疗前由于大肿瘤细胞的存在,结果显示,NSCLC患者血清CYFRA21-1水平明显高于健康对照组( P<0.05),与文献报道一致[ 5]。以>3.30 μg/L为阳性,血清CYFRA21-1对肺癌的阳性率为60.6%(40/66),由于本研究未用良性肺疾病作对照,故不能作出特异性的评价。不同细胞类型的NSCLC患者血清CYFRA21-1的表达也不一样,其中以肺鳞癌患者血清CYFRA21-1水平和阳性率最高,显著高于肺腺癌( P<0.05),这与Buccheri 等[ 6]的报道一致。
由于健康人CYFRA21-1水平变化很小,且半衰期较短,因此,在首次治疗(放化疗、手术)后不久(大约48 h后)就可检测CYFRA21-1,以评价治疗效果[ 7]。本研究结果显示,对化疗有效的患者治疗后,CYFRA21-1水平与治疗前比较明显下降( P<0.05),而对化疗抵抗的患者CYFRA21-1水平在治疗前、后变化不明显 ( P>0.05)。可能是由于CYFRA21-1为肿癌细胞分泌,其水平与瘤细胞数目相关[ 8],缓解组B1V8一过性增高,是由于肿瘤细胞大量坏死,细胞溶解释放大量的CYFRA21-1而使其表达上调,化疗第2周期前BV2与化疗第1周期前BV1比较明显降低,预示着此组NSCLC患者对化疗药物敏感[ 9, 10]。
综上所述,血清CYFRA21-1可作为早期判断NSCLC患者化疗敏感性的指标,在化疗第2周期开始前足以判断出对化疗敏感与否;以血清CYFRA21-1水平来评价早期化疗的敏感性优于CT,在评价化疗疗效方面与CT有高度相关性,对早期预测化疗药物的疗效有重要的指导价值。临床医生可在每个个体化疗的1个周期内密切监测血清CYFRA21-1水平,判断目前所用化疗方案是否有效,及时变更化疗方案,以达到最佳化疗效果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|