史敏,女,1971年生,博士,主任技师,主要研究方向为临床血液学检验。
近年假性Chediak-Higashi(pseudo-chediak-higashi,PCH)异常在急性白血病的形态学诊断、鉴别诊断与判断预后中有越来越重要的作用[
患者女,42岁,无明显诱因出现左腋下淋巴结肿大,1周后肿物增大至3×1 cm,1月后出现发热,伴有咳嗽、咳痰,不伴胸闷、胸痛、憋喘,不伴盗汗、头痛及头晕,自行口服阿司匹林、“安乃近”后体温可逐渐下降,曾在外院就诊查血常规,白细胞增高,给予抗感染治疗输注3 d,无明显好转,为进一步治疗入住河北医科大学第二医院。患者1年前行阑尾切除术。
体检:体温36.4 ℃,脉搏84次/分,呼吸20次/分,血压15.20/9.73 kPa,神清,全身皮肤黏膜未见出血点及瘀斑,左腋下可扪及一2 cm×2 cm淋巴结,触痛、质韧,无粘连。咽部稍充血,胸骨无压痛,双肺呼吸音粗,未闻及干湿性啰音,心律齐,未及杂音,腹平坦,无压痛、反跳痛及肌紧张,肝脾未触及,双下肢无水肿。
血常规:红细胞(RBC) 3.07×1012/L,血红蛋白(Hb) 95 g/L,白细胞(WBC) 92.87×109/L,血小板(PLT) 90×109/L,幼稚细胞占0.86。外周血涂片中原始及幼稚细胞胞质内未见包涵体。
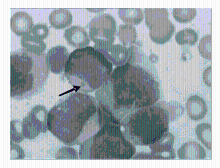
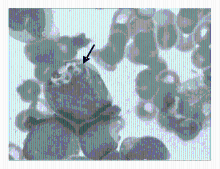
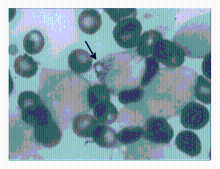
骨髓象:有核细胞增生明显活跃。其中原幼细胞占0.78,该细胞体积较大,核呈圆形或椭圆形,染色质细致,可见核仁,胞质量较丰富,染灰蓝色,部分细胞胞质中可见体积大的圆形或不规则形紫红色包涵体,部分出现于大的空泡内(图1~2):
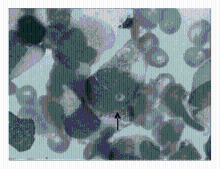
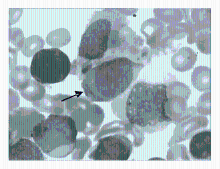
有的包涵体位于细胞核上(图3),Auer 小体易见(图4):
CT平扫:双腋下淡薄小结节影,脾大;B超检查:左腋下、左侧腹股沟多发肿大淋巴结,子宫增大,双颈部未见明显肿大淋巴结。
诊疗经过:根据临床及实验室检查,按《血液病诊断及疗效标准》[
对骨髓涂片进行过氧化酶(peroxidase,POX)染色再行瑞-姬复染;α-醋酸奈酯酶(α-NAE)染色;过碘酸-Schiff染色;酸性磷酸酶(acid phosphatase,ACP)染色采用Gomori 硫化铅法;甲苯胺蓝染色;脱氧核糖核酸染色采用Feulgen反应法。结果显示包涵体POX染色阴性(图5),空泡周围有阳性颗粒;α-NAE染色阴性;过碘酸-Schiff染色阴性;ACP染色阴性;甲苯胺蓝染色阴性;脱氧核糖核酸染色阴性。
骨髓穿刺液2 mL加入乙二胺四乙酸二钾(EDTA-K2)抗凝真空管中,与抗凝剂充分混匀,抗凝剂与骨髓液比值为1∶9。利用流式细胞仪(FACSCantoTMII,BD Biosciences,San Jose,CA,USA.)。以CD45/SSC双参数细胞亚群分布定位结合细胞多荧光方法进行分析测定。试剂选用髓系单克隆抗体CD33、CD13、CDl17、CD123、CD15、CDl4、CD64、CD11b、MPO;T淋巴细胞系:CD2、CD3、CD7;B淋巴细胞系:CDl9、CD79、CD38;系列非特异型:HLA-DR、CD34。结果显示骨髓有核细胞中异常细胞占84.71%,CD117、HLA-DR、CD33、CD38、CD123阳性,部分细胞表达CD34、CD19、CD7、CD2、CD11b,弱表达CD64、CyCD3、CyCD79a。
(1)染色体检查:于治疗前抽取患者骨髓标本,短期培养法制备染色体标本,应用R显带技术进行核型分析,每例标本至少分析20个中期细胞;染色体检查结果为46,XX[5];(2)基因检测:肝素抗凝的骨髓液2~3 mL,分离骨髓单个核细胞,制备骨髓单个核细胞总RNA,将RNA逆转录成cDNA,应用筑巢式逆转录聚合酶链反应(RT-PCR)检测NPM1、FLT3/ITD、C-KITD基因;基因检查结果为DNA-NPM1阳性、FLT3/ITD阳性、C-KITD8阴性。
PCH异常形态由Didisheim等[
文献报道细胞化学染色PCH颗粒POX阳性[
有研究[
大量研究表明细胞遗传学异常对AML患者有预后意义[
综上所述,PCH异常形态主要见于AML中,白血病细胞免疫表型CD2表达与PCH异常颗粒的形成有关,细胞遗传学对AML的预后判断也有重要意义。本例患者为伴PCH异常的急性单核细胞白血病,细胞免疫表型CD2阳性表达,细胞遗传学NPM1与FLT3/ITD阳性,对急性白血病的形态学诊断、鉴别诊断、预后判断以及深入研究白血病细胞PCH异常的发生机理提供了重要的理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|