周万青,男,1981年生,硕士,主管技师,主要从事微生物检验及耐药机制研究。
张葵, 联系电话:025-83106666-60666。
探讨临床分离的纸片扩散法药物敏感性试验对阿米卡星(AMK)呈双圈耐药的肠杆菌科细菌相关携带基因及药物诱导对耐药基因mRNA表达量的影响。
方法收集纸片扩散法药物敏感性试验对AMK呈双圈耐药的大肠埃希菌(编号Eco85)和肺炎克雷伯菌(编号Kpn110)各1株;纸片诱导法探讨耐药表型的改变;聚合酶链反应(PCR)扩增氨基糖苷类修饰酶基因、整合子及其可变区以及16S rRNA甲基化酶基因;逆转录PCR分析
Eco85和 Kpn110分别在第10代和第16代诱导后转变为双圈消失;2株菌均扩增出Ⅰ类整合子基因,可变区分别携带
大肠埃希菌和肺炎克雷伯菌对AMK呈双圈耐药可能与16S rRNA甲基化酶
To investigate the double-circle drug resistance gene to amikacin (AMK) in
One strain of
The double-circle resistance phenotype was changed to complete resistance at the tenth and sixteenth for Eco85 and Kpn110, respectively. The 2 strains were positive for integron geng Ⅰ, Eco85 and Kpn110 contained
The double-circle drug resistance to AMK in
氨基糖苷类抗菌药物作为一类高效、广谱的抗菌药物,具有浓度依赖性快速杀菌特点,一直是临床治疗革兰阴性菌所致的严重感染的重要药物。由于该类抗菌药物的过度使用,使得临床分离株对此类药物的耐药率呈逐年上升趋势[ 1]。细菌对该类药物耐药主要通过产氨基糖苷类修饰酶、16S rRNA甲基化酶以及整合子携带相关基因等途径[ 2, 3, 4]。作为氨基糖苷类药物中抗菌谱较宽的阿米卡星(amikacin, AMK)在临床上应用较为广泛。然而在纸片扩散法药物敏感性试验中,革兰阴性杆菌对AMK耐药表型可表现为2种,单纯的耐药表型和诱导耐药表型[ 5]。对于导致AMK双圈耐药的鲍曼不动杆菌相关耐药机制研究已有报道[ 5, 6],但在肠杆菌科细菌却未见报道。本研究探讨临床分离的对AMK呈双圈耐药的大肠埃希菌和肺炎克雷伯菌耐药表型改变及相关耐药基因,并探讨耐药传递机制。
收集2011年11至12月间临床样本中分离的纸片扩散法药物敏感性试验对AMK呈双圈耐药的大肠埃希菌(编号Eco85)和肺炎克雷伯菌(编号Kpn110)各1株,分别分离自分泌物和胆汁样本。菌株经ATB 32E鉴定条(法国生物梅里埃公司产品)鉴定。大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)作为质控菌株,大肠埃希菌(C600)作为接合试验受体菌。
Taq DNA聚合酶、10×缓冲液(含Mg2+)、dNTPs和逆转录聚合酶链反应(polymerase chain reaction, PCR)试剂盒为TaKaRa公司产品;DNA Marker为北京全式金公司产品;焦磷酸二乙酯为上海生工公司产品;Trizol为Invitrogen公司产品;PCR扩增仪(9600型)为美国PE公司;凝胶成像分析系统为捷达公司产品;PCR引物由英俊公司合成。
1. 诱导试验及菌株药物敏感性试验
参照文献[5]对2株菌进行AMK诱导试验。纸片扩散法操作,取AMK纸片周围内圈生长的菌落配成0.5麦氏浊度涂布后贴AMK药物敏感性纸片,35 ℃ 培养18 h,重复操作直至纸片周围无抑菌圈为止,离纸片最近圈菌株即为诱导后菌株。采用纸片扩散法测定菌株对庆大霉素和妥布霉素的药物敏感性;采用琼脂稀释法分别对诱导前后菌株进行AMK最低抑菌浓度(minimal inhibitory concentration, MIC)测定,药物浓度为0.5 ~2 048 mg/L。根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)2011年标准[ 7]进行结果判读。
2. 细菌DNA提取
挑取纯培养菌落置于0.5 mL离心管内(内预置200 ng/mL蛋白酶K溶液200 μL),56 ℃水浴2 h,改95 ℃水浴10 min,13 000× g离心30 s。上清液即为基因检测的模板液,置-20 ℃冰箱备用。
3. 基因检测
参照文献[2, 8]分别合成氨基糖苷类修饰酶基因、Ⅰ~Ⅲ类整合酶基因和整合子可变区以及16S rRNA甲基化酶基因扩增引物,序列见表1。总反应体系为50 μL,其中10×缓冲液(含Mg2+) 5 μL,dNTPs (各2.5 mmol/L) 4 μL,DNA模板2 μL,上下游引物(10 μmol/L)各2 μL,Taq DNA酶0.3 μL,ddH2O 34.7 μL,退火温度为55 ℃。PCR产物经1.5%的琼脂糖凝胶电泳观察。将PCR扩增阳性产物送上海美吉公司测序,结果在GenBank上比对。
4. 逆转录PCR
用Invitrogen公司Trizol试剂盒分别提取AMK诱导前后菌株总RNA,并用TaKaRa公司逆转录试剂盒合成cDNA,置于-20 ℃保存。16S rRNA内参引物[ 9]见表1:
| 表1 靶基因PCR引物序列及产物大小 |
目的基因 armA和内参基因扩增条件为:预变性94 ℃ 5 min;94 ℃ 30 s,55 ℃ 50 s,72 ℃ 50 s,共30个循环;最后延伸72 ℃ 7 min。PCR产物经1.5%的琼脂糖凝胶电泳观察并扫描灰度值进行半定量分析。
5. 接合试验
对数生长期的供体菌及受体菌(对利福平耐药的大肠埃希菌C600)各0.2 mL加到0.6 mL新鲜LB肉汤中,37 ℃过夜培养后接种含AMK(64 mg/L)和利福平(256 mg/L)的水解酪蛋白胨平板筛选接合子。供体菌和受体菌作为质控菌。
数据均用SPSS 16.0统计软件进行分析,2组间比较采用配对 t检验, P<0.05为差异有统计学意义。
经过连续诱导传代试验,Eco85和Kpn110分别在第10代和第16代后转变为抑菌圈消失,呈现完全耐药表型。诱导前后AMK药物敏感性表型结果见图1。2株菌对庆大霉素和妥布霉素并未出现上述耐药表型,而是完全耐药表型。诱导前后菌株对AMK的MIC值显示均为耐药(MIC>512 mg/L)。
注:左侧为诱导前;右侧为诱导后
6种氨基糖苷类修饰酶基因检测结果显示,Eco85和Kpn110分别扩增出 aac(6) -Ⅰ和 ant (3″)-Ⅰ基因,其余基因检测均为阴性;2株菌中均扩增出Ⅰ类整合子,但携带不同的整合子可变区基因盒,Eco85可变区基因盒为 aadA5 -dfra17(1.6 kb),基因登录号为GU055937.1,Kpn110可变区基因盒为 aadA2 -dfrA12(1.8 kb),基因登录号为GU001949.1,未检出Ⅱ类、Ⅲ类整合子基因;诱导前后2株菌均扩增出 armA甲基化酶基因,测序结果未发现基因突变,未检出 rmtB基因。
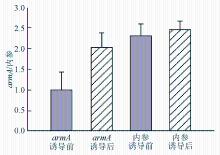
药物诱导前后菌体内均有 armA基因mRNA表达,目的条带及内参基因条带清晰可见。通过灰度扫描,药物诱导前相对基因表达量为0.987±0.428,药物诱导后相对基因表达量为2.026±0.356,2组间差异具有统计学意义( P<0 .05)。证明诱导后 armA基因表达明显不同于诱导前,见图2:
诱导前后目的基因及内参基因的电泳图谱见图3:
注:M为DNA marker; 1、2和5、6分别为诱导前后 armA; 3、4和7、8分别为诱导前后内参基因
2株菌接合试验结果均为阴性。
氨基糖苷类抗菌药物具有浓度依赖性快速杀菌作用,广泛应用于革兰阴性杆菌所致的败血症、感染性心内膜炎和其他严重感染[ 1]。AMK是氨基糖苷类半合成抗菌药物,其抗菌谱在氨基糖苷类抗菌药物中最宽,但耐药菌的出现越来越大地限制了该类抗菌药物的应用。革兰阴性杆菌对氨基糖苷类药物产生耐药与氨基糖苷类修饰酶基因、整合子基因以及16S rRNA甲基化酶基因的存在密切相关[ 2, 3, 4]。
在纸片扩散法药物敏感性试验中,革兰阴性杆菌对AMK耐药表型可表现为2种,单纯的耐药表型和诱导耐药表型[ 5, 6]。有学者针对临床分离鲍曼不动杆菌对AMK呈现出双圈耐药表型进行了一系列相关研究[ 5, 6],而对于肠杆菌科细菌中这种耐药表型现象并未见报道。本研究检出2株呈现出相同耐药表型的肠杆菌科细菌,分别为大肠埃希菌Eco85和肺炎克雷伯菌Kpn110。药物敏感性试验结果显示,2株菌同时对庆大霉素和妥布霉素呈现出耐药,但未出现双圈表型。造成这种不同的表型可能与药物的结构有关。经过AMK诱导试验,分别在第10代和第16代诱导后呈现出完全耐药,双圈消失,说明这种耐药表型的转变在肠杆菌科细菌中是可以经过诱导的。在对AMK的MIC试验显示,诱导前后菌株对AMK均为耐药,MIC值均>512 mg/L。
相关耐药基因检测结果发现,2株菌株均携带Ⅰ类整合酶基因,但可变区并未携带氨基糖苷类相关耐药基因。在所检测的6种氨基糖苷类修饰酶基因中,发现Eco85和Kpn110分别仅扩增出 aac(6) -Ⅰ和 ant (3 ″)-Ⅰ基因。而2株菌株均携带 armA基因,由此可见,该基因可导致菌株对氨基糖苷类药物的高水平耐药。对于诱导前后菌株 armA基因的mRNA半定量检测分析表明,诱导后菌株 armA基因mRNA水平明显增高,说明造成这2株菌株对AMK呈双圈耐药表型的出现与 armA基因的诱导表达相关。有研究显示,造成鲍曼不动杆菌双圈耐药表型的出现与aacA4基因的诱导表达相关[ 6],而在本研究中所发现的2株肠杆菌科细菌中并未检测到该基因。由此我们推测,在肠杆菌科细菌中这种耐药表型的出现与非发酵菌有所不同。造成这种耐药表型的出现在不同菌株间可由不同基因所介导。菌株诱导前后 armA基因测序结果完全一致,说明该基因在诱导前后并未发生变化,造成基因高表达可能与该基因上游存在某些调控基因相关,具体机制尚待进一步研究。由于本研究菌株数较少,尚需扩大样本量以进一步验证。
有文献报道16S rRNA甲基化酶 armA基因是复合转座子Tn1548的一部分,可通过质粒介导扩散导致革兰阴性杆菌对氨基糖苷类抗菌药物耐药并造成临床耐药菌株的传播[ 10]。但本研究2株菌株接合试验结果均未成功,推测该基因可能存在于染色体上,并未存在于可转移的质粒上。而对于诱导前后的2株菌株对其他药物敏感性检测分析发现,Eco85在诱导前后药物敏感性上并无太大改变;而Kpn110在诱导前后对头孢菌素类药物由耐药转变为敏感。对超广谱β-内酰胺酶(extended spectrum beta-lactamase, ESBLs)相关基因的检测结果表明,Kpn110在诱导后发生 DHA-1和 CTX基因的丢失(结果未列出)。推测该株肺炎克雷伯菌在诱导过程中发生以上2种基因质粒的丢失,从而造成诱导后菌株对头孢菌素类药物由原来的耐药转变为敏感,具体机制尚待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|