作者简介:叶芸,女,1974年生,硕士,副主任技师,主要从事免疫学及分子生物学研究。
了解本地区社区呼吸道感染肺炎支原体(
对400例社区获得性呼吸道感染患儿咽拭子标本进行分离培养,应用巢式聚合酶链反应(PCR)对临床分离株进行分子鉴定;通过体外药物敏感试验测定Mp临床分离株对大环内酯类抗菌药物的最小抑菌浓度(MIC),并筛选出耐药株;检测耐药株23SrRNA基因序列,并与标准菌株M129基因序列对比分析,分析突变位点与耐药表型的关系。
结果400例咽拭子标本中分离Mp 50株。其中敏感株32株,耐药株18株。18株耐药株分别出现A2063G、A2064G、A2067G 位点突变。A2063G突变株表现出对14元环大环内酯类抗菌药物耐药,A2064G突变株表现为对14、16元环大环内酯类抗菌药物的耐药,A2067G突变株表现出对交沙霉素耐药。
结论Mp对大环内酯类抗菌药物耐药现象严重,23SrRNA基因位点突变是耐药性产生的主要机制。通过对23SrRNA基因突变位点与耐药表型的分析研究,初步了解临床肺炎支原体耐药现状,并且为抗菌药物的合理选择和应用提供理论指导。
To investigate the infection situation of
A total of 400 throat swab specimens of community-acquired respiratory tract infection were cultured to isolate Mp,the clinical isolates were identified by nested polymerase chain reaction,and the in vitro antibiotic sensitivity test was performed for identifying macrolide-resistant isolates through the minimal inhibitory concentration(MIC).The sequences of macrolide-resistant 23SrRNA gene were detected. The sequences were compared to the corresponding sequences of M129. The relationship between mutation site and drug resistance phenotype was analyzed.
ResultsA total of 50 Mp were isolated from 400 throat swab specimens.Of the 50 isolates,32 isolates were susceptible to macrolide,and 18 isolates were resistant to macrolide.The 18 clinical isolates appeared mutation A2063G,A2064G and A2067G, separately. A2063G showed 14 ring macrolide resistance.A2064G showed 14 and 16 ring macrolide resistances. A2067G showed josamycin resistance.
ConclusionsMp to macrolide resistance is serious,and the mutation of 23SrRNA gene is a predominant mechanism that contributes to the macrolide resistance. Through the analysis of 23SrRNA gene mutation site and drug resistance phenotype,the clinical Mp drug resistance situation is obtained. The theoretical guidance for reasonable selection and application of antibiotics is provided.
肺炎支原体(Mp)是儿童和青少年社区获得性呼吸道感染的常见病原体之一,其导致的肺炎及肺外并发症对儿童健康危害严重[ 1, 2]。Mp缺乏细胞壁,故对作用于细胞壁的抗菌药物如青霉素类、头孢菌素类不敏感,而对影响细菌蛋白质合成的抗菌药物如大环内酯类、喹诺酮类等敏感[ 3]。由于儿童处于生长发育期,能够用于治疗儿童 Mp感染的药物选择更少,首选大环内酯类药物,主要为14元环的红霉素和15元环的阿奇霉素。近年来已有多个国家报道了Mp红霉素耐药株的出现[ 4, 5]。目前耐药机制的研究热点主要为大环内酯类抗菌药物作用靶位的基因突变。我国也有Mp耐药株的报道,且耐药现象严重,造成有效抗菌药物失效。但对于肺炎支原体23SrRNA基因突变位点与耐药表型之间的关系缺乏系统研究。为了解本地区社区呼吸道感染肺炎支原体感染状况及进一步明确Mp对大环内酯类抗菌药物的耐药机制及基因突变位点与耐药表型之间的关系,我们从临床分离培养的Mp中筛选耐药株,并对23SrRNA药物作用靶位基因进行检测,系统分析肺炎支原体23SrRNA基因突变位点与耐药表型之间的关系。
研究对象为2008年6月至2010年6月西安医学院附属医院儿科社区获得性呼吸道感染患儿400例,男250例,女150例,年龄1~12岁。
1.Mp培养基制备
在70 mL支原体(PPLO)基础培养基中加入新生小牛血清20 mL、50%鲜酵母浸液5 mL、1%酚红指示剂200μL、20%葡萄糖2.5 mL、2.5%醋酸铊1 mL、200 000 U/ mL青霉素0.5 mL。新鲜小牛血清由郑州益康生物有限公司生产;鲜酵母由博而特生物科技有限公司提供 ;酚红指示剂购自国药集团化学试剂有限公司;抗菌药物购自深圳致君制药有限公司。
2.标本采集及培养
用灭菌棉签擦拭感染期患儿咽后壁分泌物,经处理后接种于Mp培养基中,混匀后置 37 ℃温箱中孵育,并设置阴性与阳性对照。如果有Mp生长,将发酵葡萄糖产酸,使培养基pH值下降,指示剂发生颜色变化,并与阳性对照做对比。颜色由红变黄可作为有 Mp生长的指征。
3. Mp临床分离株的分子鉴定
Mp聚合酶链反应(PCR)荧光探针法定量检测试剂盒由中山大学达安基因股份有限公司提供。
4.体外药物敏感试验
按照美国国家临床实验室标准委员会(NCCLS)标准判定每株对大环内酯类抗菌药物的敏感性,采用微量稀释法测定临床分离株的最小抑菌浓度(MIC)[ 6, 7]。用Mp液体培养基倍比稀释药物,从256 mg/L稀释至0.001 mg/L。各管中加入等量菌液(质量浓度为 1×108 CCU/L),置于 37 ℃二氧化碳温箱孵育。8种药物标准品均购自中国药品生物制品检定所,其中14元环大环内酯类抗菌药物包括红霉素、克拉霉素、罗红霉素,16元环大环内酯类抗菌药物包括交沙霉素、麦迪霉素、泰利霉素、螺旋霉素,15元环大环内酯类抗菌药物为阿奇霉素。Mp标准株 M129作为质控菌株,凡是MIC值超出标准株MIC值4倍以上,将其判为耐药。
5.提取临床分离株DNA
将冷冻保存的Mp菌株取出后传代复苏。当生长时间较稳定后(约7 d),吸取 20 μL菌液置于 1.5 mL离心管中,以 13 000× g离心 10 min,弃去上清液后,然加标本处理液 200 μL并混匀,在 100 ℃沸水中水浴10 min,此溶液作为 DNA模板备用。
6.PCR扩增目的基因片段及 DNA测序
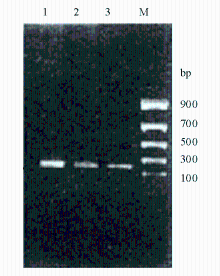
根据GenBank数据库中的Mp 23S rRNA核酸序列(NC_000912)利用生物学软件Primer 5.0自行设计巢式 PCR扩增所需的引物,见 表1。扩增体系为: Mp-1F和Mp-1R引物各15 pmol,TaqDNA聚合酶 1 U,总反应体积20 μL,其中模板液5 μL。热循环参数为93 ℃预变性2 min、93 ℃ 1 min、50 ℃ 1 min、72 ℃ 1 min,共 35个循环,最后1个循环 72 ℃延长 5 min,扩增产物为290 bp。然后取 2 μL作为模板继续进行第2轮扩增,用Mp-2F和Mp-2R作为引物,其余条件相同,完成第2次扩增。扩增终产物为244 bp并对其进行电泳,检测是否存在目的片段。对于经电泳检测阳性的标本,将过夜培养的菌液直接取1 mL放离心管中送往上海生工生物技术服务有限公司进行测序,测得序列与 NCBI已登录的Mp标准株 M129(ATCC 29342D)相应基因序列作比对,每次实验均设立阳性和阴性对照[ 7, 8]。
| 表1 巢式PCR扩增引物及产物大小 |
400份咽拭子标本共分离培养出Mp 50株 ,分离阳性率为 12.5%。应用PCR荧光探针法定量检测证实均为Mp 。
按照美国国家临床实验室标准化委员会制定的标准,对分离培养阳性的50株Mp及标准株 M129进行体外药物敏感试验,判定时间为5~14 d,结果发现其中32株(64%)敏感,18株(36%)耐药。见 表2。
| 表2 32株敏感株的MIC(μg/mL) |
1.产物电泳
巢式PCR扩增出现的目的条带见 图1。
2.DNA测序
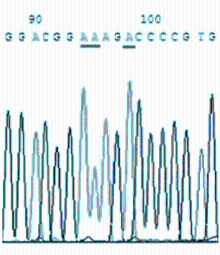
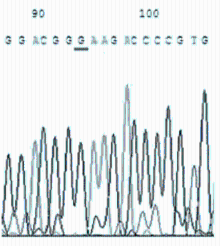
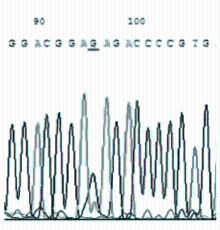
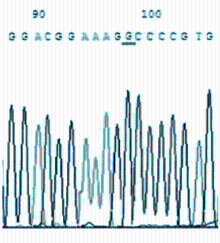
敏感株与耐药株的DNA测序结果见 图25。
对分离培养阳性的50株 Mp 及标准株 M129进行测序分析,其中32株敏感株与标准株M129比较均未发生基因位点突变。18株耐药株分别出现A2063G(12/16)、A2064G(3/16)、A2067G(1/16)位点突变,且以A2063G为主(约占75%),有2株耐药菌株无基因位点的突变。A2063G突变株表现为对14元环大环内酯类抗菌药物耐药,A2064G突变株表现为对14、16元环大环内酯类抗菌药物耐药,A2067G突变株表现为对交沙霉素耐药。见 表3。
| 表3 18株耐药株体外药物敏感试验检测结果与突变位点结果 |
Mp近年来感染呈加重趋势,所导致的肺炎和肺外并发症对儿童健康危害严重[ 8, 9, 10]。鉴于其自身的结构特点和儿童处于生长发育期的特殊性,大环内酯类抗菌药物成为治疗儿童Mp感染的首选药物。大环内酯类抗菌药物通过抑制细菌蛋白质的合成而发挥抑菌作用。作用靶位是细菌核糖体50S大亚基,结合于转肽酶中心与肽输出通道狭窄之间的部分,通过机械性的阻塞通道而抑制新生肽链的延伸,从而阻碍蛋白质的合成[ 11]。同时还可抑制核糖体50S大亚基的组装,导致细胞内有功能的核糖体数量下降,细菌蛋白合成能力下降,结合位点多位于23SrRNAV区中心环的A2063、A2064位[ 12]。
Morozumi等[ 13]分析20022006年Mp菌株对大环内酯类耐药的情况,发现耐药株的出现频率呈增快趋势。在一定程度上说明Mp对大环内酯类抗菌药物耐药非常严重。Pereyre 等[ 4]2007年首次报道出现了Mp耐药株,且认为Mp对大环内酯类耐药的主要机制是23SrRNA发生点突变。Mp耐药株的出现造成有效治疗抗菌药物的失效,影响了临床转归。目前认为Mp耐药机制有以下几种:(1)靶位改变:基因突变或甲基化;(2)主动外排;(3)药物灭活[ 14]。根据以往研究结果[ 15],说明某些位点突变与耐药表型之间有因果关系,但其突变位点与耐药表型之间的关系需要进一步证实。
本研究从400份社区获得性呼吸道感染患儿咽拭子标本共分离培养出 Mp 50株 ,分离阳性率为 12.5%。分离阳性率较其他地区低[ 16],分析原因为采集标本前部分患儿使用过大环内酯类药物导致Mp已被抑制。因此不能真正反映Mp对大环内酯类抗菌药物的耐药率。分离培养阳性的50株中有18株耐药,耐药率36%。进一步说明本地区患儿中大环内酯类耐药肺炎支原体比例非常高,需要引起临床的高度重视。
本研究分离培养并筛选了18株对大环内酯类耐药的 Mp阳性地方株,并研究了其可能的耐药机制,结果证实23SrRNA V区靶位基因突变是耐药性产生的主要机制。18株耐药株分别出现A2063G(12/16)、A2064G(3/16)、A2067G(1/16)位点突变,且以A2063G为主(约占75%)。有2株耐药菌株无基因位点的突变,分析其耐药可能与Mp耐药的其他机制有关。A2063G突变株表现出对14元环大环内酯耐药,A2064G突变株表现为对14、16元环大环内酯耐药, A2067G突变株表现出对交沙霉素耐药。
本研究对所有Mp感染病例给予阿奇霉素治疗,32例对大环内酯类敏感未发生基因突变患者3~7 d 发热消失,1周左右咳嗽减轻,治疗2周后复查胸片显示炎性反应基本吸收。16例对大环内酯类耐药发生基因突变患者6~10 d 发热消失,2周左右咳嗽减轻,治疗3周后复查胸片显示炎性反应基本吸收。2例对大环内酯类耐药未发生基因突变患者患者治疗后仍有肺纹理增粗,选用左氧氟沙星继续治疗1周后逐渐恢复正常。提示耐药肺炎支原体感染具有难治性,可导致患儿病程延长,给临床治疗带来困难。
总之,本研究通过对肺炎支原体23SrRNA基因突变位点与耐药表型的分析,初步了解了本地区临床肺炎支原体耐药现状及基因突变位点与耐药表型之间的关系。但由于研究例数不多,尚存在局限性,且体外药敏试验对大环内酯类耐药的临床意义尚不十分明确,因此有必要通过复制动物模型来进一步研究,为临床上合理应用抗菌药物提供参考,从而提高临床对耐药 Mp 的诊治水平。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|