作者简介:周运恒,男,1976年生,博士,主管技师,主要从事临床免疫学及微生物学检验工作。
通讯作者:仲人前,联系电话:021-81886071。
探讨细胞因子信号转导抑制分子1(SOCS1)干扰后,线粒体M2蛋白对外周血单个核细胞(PBMC)来源的树突状细胞(DC)功能的影响。
方法诱导和培养健康人PBMC来源DC,小干扰RNA(siRNA)抑制SOCS1的表达,用不同浓度的M2蛋白刺激DC,用流式细胞术 (FCM )分析DC表型CD83、CD86的表达,用酶联免疫吸附试验(ELISA)检测DC培养上清液中白细胞介素10(IL-10)和白细胞介素12(IL-12)的变化。
结果DC在M2蛋白浓度为70 μg/mL刺激24 h,35 μg/mL刺激24、48和72 h时,与对照组比较,CD83和CD86的表达率以及IL-10和IL-12的水平均明显升高( P<0.05)。M2蛋白刺激SOCS1干扰后的DC,在不同刺激浓度和作用时间,CD83和CD86表达率以及IL-12水平与单纯M2蛋白刺激组相比均明显升高( P<0.05),而IL-10水平在两者之间差异无统计学意义( P>0.05)。
结论DC在接受高浓度的M2蛋白刺激后,其成熟度、抗原递呈和Th1的极化能力增强;抑制SOCS1的表达,M2蛋白可进一步促进DC功能的增强,可能导致自身耐受的破坏。
To study the influence of mitochondrial M2 protein on peripheral blood mononuclear cell(PBMC)-derived dendritic cells (DC) after silencing suppressor of cytokine signaling 1 (SOCS1).
MethodsDC from PBMC of healthy subjects were induced and cultured. The SOCS1 expression was silenced by small interfering RNA (siRNA). DC were stimulated by various concentrations of M2 protein, and the expressions of CD83 and CD86 of DC were performed by flow cytometry(FCM).The levels of interleukin-10(IL-10) and interleukin-12(IL-12) in culture supernatant of DC were measured by enzyme-linked immunosorbent assay (ELISA).
ResultsThe expressions of CD83 and CD86 and the levels of IL-10 and IL-12 of DC under the stimulation of M2 protein at 70 μg/mL after 24 h and at 35 μg/mL after 24, 48 and 72 h were all significantly higher than those in the control group( P<0.05). After silencing SOCS1 by siRNA of DC with various concentrations of M2 protein at different times, the expressions of CD83 and CD86 and the levels of IL-12 all increased more significantly than those in the M2 protein stimulating group( P<0.05). However, there was no significant difference for IL-10 levels of DC between the 2 groups( P>0.05).
ConclusionsDC after stimulation of M2 protein at high concentration has increased the capacity to activate Th1 subset proliferation, maturation and antigen presentation. The functions are further enhanced after silencing SOCS1 of DC in the presence of M2 protein, which maybe contribute to the break of self-tolerance.
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)是一种慢性胆汁淤积性自身免疫性疾病, 发病机制不明, 高滴度的抗线粒体抗体(anti-mitochondrial antibody, AMA)是PBC血清学诊断标志。AMA可分为M1~M9共9个亚型, 而抗M2亚型是PBC的特异性抗体, 其特异性可达95%以上[1, 2]。用基因工程的方法克隆表达抗原蛋白三联体(简称线粒体M2蛋白), 可检测M2抗原在PBC患者的分布情况[3]。细胞因子信号转导抑制分子1(suppressor of cytokine signaling 1, SOCS1)可负调控树突状细胞(dendritic cell, DC)的激活, 并参与T淋巴细胞的分化和免疫调控等活动[4, 5]。既往研究发现在PBC患者外周血诱导的DC中, SOCS1的蛋白表达水平降低, DC更倾向于成熟状态[6]。我们主要用M2蛋白刺激外周血来源的DC, 探讨SOCS1表达降低前后线粒体M2蛋白对DC功能的影响。
M2蛋白由上海富纯中南生物技术公司惠赠, 脂质体LipofectamineTM 2000(美国invitrogen公司), GENMED 蛋白酶/磷酸酶完全抑制混合液(美国GENMED SCIENDIFICS INC公司), SOCS1小干扰RNA(siRNA)由上海吉玛制药技术有限公司设计, 淋巴细胞分离液(上海国药集团化学试剂有限公司), RPMI-1640培养基(奥地利PAA PAA Laboratories GmbH公司), 六孔细胞培养板(美国Corning公司), 细胞因子人重组白细胞介素4(rhIL-4)、粒细胞-巨噬细胞集落刺激因子(rhGM-CSF, 美国R@D公司), 白细胞介素10(IL-10)和白细胞介素12(IL-12, 美国eBioscience公司)。不完全培养基为RPMI-1640+青霉素(100 U/mL)+链霉素(100 ng/mL), 完全培养基为RPMI-1640+10%胎牛血清+rhGM-CSF(10 ng/mL)+rhIL-4(10 ng/mL)+青霉素(100 U/mL)+链霉素(100 ng/mL)。荧光抗体为CD86单抗及二抗(美国BD-Pharmingen公司)、CD83单抗(美国Ancell 公司)。SOCS及内参GAPDH引物合成由上海生工生物工程有限公司完成, SYBR Green Realtime PCR Master Mix (日本ToYoBo公司)。FC500流式细胞仪(美国Beckman-Coulter公司), ABI Prism7000荧光定量聚合酶链反应(PCR)仪(美国Applied Biosystems公司), LEICA-DMLB荧光显微镜(德国Leica Microsystems公司)。
1. 外周血单个核细胞(PBMC)的分离和DC的诱导及培养 在健康献血者知情同意下, 收集滤去红细胞后的全白细胞, 用淋巴细胞分离液收集PBMC, 加入不完全培养基, 调整细胞密度为2× 106/mL左右, 加入6孔板, 每孔3 mL, 37 ℃ 5% CO2培养箱温育过夜。用吸管取出上清液及非贴壁细胞, 剩余的贴壁细胞用温无血清培养基洗涤2次, 加入完全培养基, 37 ℃ 5% CO2培养箱温育3 d, 第4天用完全培养基换液, 培养至第7天, 用细胞刮收集, 进行形态学观察, 并用流式细胞术(flow cytometry, FCM)进行表型鉴定[7]。
2. SOCS1 siRNA转染及干扰效率检测 转染前, 收集培养第7天的DC, 用含5%小牛血清且不含抗菌药物的RPMI-1640培养液调整细胞浓度, 6孔板每孔2 mL培养液(含5× 105个细胞), 37 ℃ 5% CO2培养过夜; 取1 μ L/孔脂质体LipofectamineTM2000, 用50 μ L不含血清的RPMI-1640稀释, 轻轻混合后在室温温育5 min; 取2 μ L羧基荧光素(carboxyfluorescein, FAM) 标记的siRNA(SOCS1-16, SOCS1-156和SOCS1-369), 用50 μ L不含血清的RPMI-1640稀释, 轻轻混合均匀; 稀释后的脂质体LipofectamineTM2000经过5 min的孵育, 与稀释的siRNA轻轻混合, 室温静止20 min, 以形成siRNA-转染试剂混合物; 将转染混合液加入相应的培养细胞孔, siRNA终浓度为100 nmol/L, 同时设阴性对照和FAM标记的阴性对照, 其余孔以培养基为对照; 转染后6 h收集加入FAM标记的阴性对照孔, 用荧光显微镜检测转染效率; 其余孔将培养基换为含血清的RPMI-1640, 继续培养, 转染后24 h收集各孔细胞。
3. M2蛋白与DC共育 分别收集培养第7天的DC和SOCS1 siRNA转染24 h后的DC, 用完全培养基调整细胞浓度, 继续接种至6孔板, 每孔约为2× 106个细胞; 分别加入7、14和70 μ g/mL的M2蛋白, 刺激DC, 相同条件设复孔, 并以未受任何刺激的DC为对照组, 24 h后收集各孔DC以及培养上清; 其余孔加入35 μ g/mL的M2蛋白刺激DC, 在12、24、48和72 h后收集细胞以及培养上清, 培养上清用于细胞因子检测, FCM检测DC表面标记。
4. FCM检测DC细胞表型 用FCM标记液PBA[0.01 mol/L磷酸盐缓冲液(PBS)+2%牛血清白蛋白(BSA)+0.01% NaN3]悬浮细胞(5~10)× 105/mL, 加入离心管(100 μ L/管), 分别用间接法和直接法检测DC的CD86和CD83。直接法取100 μ L细胞/管加入一抗9 μ L, 室温避光20 min, 1 500× g离心3 min, PBS洗细胞2次。间接法加入荧光标记的一抗2 μ L, 单抗浓度为5 μ g/mL, 冰浴30 min, 1 500× g离心3 min, PBS洗细胞2次, 加入羊抗鼠IgG荧光二抗50 μ L/管, 二抗浓度为2 μ g/mL, 冰浴30 min, 1 500× g离心3 min, PBS洗细胞2次, 细胞悬于含有1%多聚甲醛的PBS荧光染色细胞保存液中。同一标本重复检测2次取平均值。
5. 培养上清细胞因子的检测 在DC培养第7 天时分别收集2组培养的上清液, 用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测培养上清液中细胞因子IL-10和IL-12的变化, 所有标本重复做3孔, 计算平均吸光度(A)值, 按ELISA试剂盒说明书操作。
采用SPSS 15.0软件统计分析, 数据用
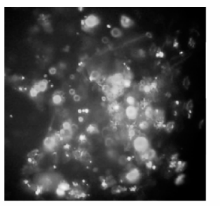
利用FAM标记的阴性对照可以判断siRNA转染效率。通过荧光显微镜可以看出, siRNA的转染效率很高, 可以达到95%左右, 说明转染成功。见图1。
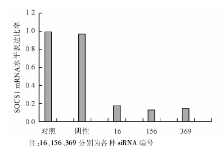
转染24 h后, 抽提细胞总RNA, 逆转录为cDNA, 用PCR测定DC的SOCS1表达变化, 以不加任何处理因素的DC作为对照组, 根据公式Δ Ct=[Ct(目的基因)]-[Ct(内参基因)]和Δ Δ Ct=[Δ Ct(实验组)]-[Δ Ct(对照组)]计算2-Δ Δ Ct, 即为各组基因表达量相对于对照组的倍数。发现3条siRNA表达载体中, 编号为156的抑制效率最高, 见图2。
DC在M2蛋白浓度为70 μ g/mL刺激24 h, 35 μ g/mL刺激24、48和72 h时, CD83和CD86的表达率均高于对照组, 另外CD83在DC受到14 μ g/mL的M2蛋白刺激24 h后与对照组相比也升高, 差异有统计学意义(P< 0.05); 而在SOCS1干扰后再接受M2蛋白刺激, 发现各个刺激浓度和作用时间点的CD83和CD86表达率与单纯M2蛋白刺激组相比均升高, 差异有统计学意义(P< 0.05)。见表1、表2。
| 表1 不同浓度的M2蛋白刺激DC 24 h后CD83和CD86的表达 |
| 表2 35 μ g/mL的M2蛋白刺激DC不同时间后CD83和CD86的表达 |
通过ELISA测定不同刺激条件下DC分泌的IL-10和IL-12的变化, 发现DC在M2蛋白浓度为70 μ g/mL刺激24 h, 35 μ g/mL刺激24、48和72 h时, 与M2蛋白刺激的对照组相比, IL-10和IL-12的水平均升高, 差异有统计学意义(P< 0.05), 在其他刺激浓度和作用时间点IL-10和IL-12的水平并无明显变化(P> 0.05); 而在SOCS1干扰后再接受M2蛋白刺激, 发现各刺激浓度和作用时间点的IL-12水平与单纯M2蛋白刺激相比均升高, 其中在35 μ g/mL刺激48 h时IL-12水平达到最高, 差异有统计学意义(P< 0.05), 而IL-10在两者之间差异无统计学意义(P> 0.05)。见表3、表4。
| 表3 不同浓度的M2蛋白刺激DC 24 h后IL-12和IL-10的变化 |
| 表4 35 μ g/mL的M2蛋白刺激DC不同时间后IL-12和IL-10的变化 |
线粒体M2亚型有多个抗原, 其中最主要的3个是丙酮酸脱氢酶复合体E2亚基(E2 components of the pyruvate dehydrogenase complexes, PDC-E2, 85%~95%的PBC患者阳性)。侧链二氧酸脱氢酶复合体E2(2-oxo-acid dehydrogenase complex E2, BCOADC-E2)和2-氧戊二酸脱氢酶复合体E2(2-oxo-glutarate dehydrogenase complex E2, OGDC-E2)[8, 9]。线粒体M2蛋白可以上调单核细胞Toll样受体4(Toll-like receptor 4, TLR4)的表达, 通过活化TLR4信号转导通路, 引起PBC发病, 还可诱导C57BL/6小鼠建立PBC模型, 其生化和病理特征与人类PBC早期相似[10, 11]。在AMA和肝内浸润的T细胞针对的主要抗原是PDC-E2, 对PDC-E2自身抗原的免疫耐受被打破, 可能是PBC发病的原因之一[12]。
近年来大量研究显示, DC的成熟状态决定其功能的发挥, DC功能的异常与自身免疫性疾病的发病关系密切[13, 14]。DC具有高效的抗原摄取和处理能力, 可诱导抗原特异性耐受, 遇到感染等刺激信号后, 随即对抗原进行加工处理, 逐渐成熟、增殖并分泌多种细胞因子, 上调协同刺激分子如CD40、CD80/CD86的表达, 其递呈抗原的能力逐渐增强, 并通过IL-12的分泌共同导致Th细胞的激活[15, 16]。本研究中, 在M2蛋白低浓度刺激下, DC的细胞表型和分泌的细胞因子均无明显变化, 当浓度达到35 μ g/mL刺激24 h后, DC的CD83和CD86表达均升高, IL-12的分泌也增加。说明其抗原递呈能力增强, 这可能与DC接触高浓度的外来抗原M2蛋白后, 其作为抗原递呈细胞本能的发挥递呈作用有关, 这些变化可能与脂多糖(LPS)刺激后DC的反应类似[17, 18]。
而SOCS1干扰后再接受M2蛋白的刺激, CD83、CD86和IL-12也明显升高, 显示其抗原递呈能力进一步增强, 说明SOCS1可以负调控DC的成熟, 这与前期研究PBC患者DC中SOCS1表达降低, 免疫耐受破坏和DC递呈功能增强相一致[6]。siRNA技术以其具有的高效性、严格的序列特异性和高度的稳定性成为研究基因功能的有效工具[19]。我们通过SOCS1干扰试验发现抑制效率很高, siRNA的转染效率很高, 可以进行下一步的研究。有研究表明SOCS1是DC介导的T细胞激活和保持免疫耐受必须的负调控蛋白, 正常DC可以激活自主反应性T细胞, 但很少引起自身免疫性疾病, 提示自身耐受, 而SOCS1基因沉默后的DC可以诱导IL-12的产生, 可以诱导Th1的功能, 从而增强迟发性超敏反应和细胞毒性T细胞产生, 打破免疫耐受[20]。
IL-10在不同浓度的M2蛋白刺激不同时间后, 干扰组与单纯M2刺激组的变化差异无统计学意义。IL-10主要由Th2细胞产生, 除了能一定程度地促进细胞毒性T淋巴细胞诱导、增强B细胞增殖分化外, 其主要生物学活性是起免疫抑制作用, 能抑制 Th1 细胞的增殖及γ 干扰素(interferon-γ , IFN-γ )等细胞因子的合成, 又限制机体过度异常的免疫反应, 结果使感染向慢性转化。Nagano等[21]发现早期PBC患者的肝组织中IL-6和IFN-γ 的水平升高, 降低的有IL-10。这些结果表明Th1型细胞因子在PBC中起重要作用。
有研究发现DC在成熟过程中, 除了Janus激酶-信号转导和转录激活因子 (janus kinase-signal transducer and activator of transcription, JAK-STAT)信号通路外, 还有多条信号通路起作用[22]。而SOCS1也是TLR和JAK-STAT信号通路的负调控蛋白, 尽管不清楚SOCS1具体是通过哪条或哪几条通路来影响DC的成熟和功能的发挥, 但通过siRNA技术降低DC中SOCS1的表达, 可以促进DC的成熟, 增强其抗原递呈能力, 促进Th1细胞的分化, 从而打破机体的免疫耐受和增强Th1型细胞免疫的作用。今后可通过M2蛋白诱导的PBC小鼠模型或研究JAK-STAT通路和TLR通路中SOCS1的下游分子来进一步探讨SOCS1在PBC发病机制中的作用。目前通过动物实验已经证实SOCS1可以治疗许多有细胞因子信号通路参与的感染性和免疫性疾病。用SOCS1分子模拟物, 如TKIP(tyrosine kinase inhibitor peptide)可以抑制JAK-STAT的磷酸化作用, 从而控制实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)的发展[23]; 或者通过siRNA技术抑制SOCS1蛋白的表达来增强细胞的抗肿瘤和抗病毒效果等[24]。因此推测在临床上通过SOCS1的模拟物抑制体内DC的成熟, 并维持机体的免疫耐受作用和控制Th1细胞的极化, 从而为PBC患者提供新的免疫学治疗靶点。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|