作者简介:廖晚珍,男,1952年生,副主任技师,主要从事临床细菌学与真菌学、分子生物学研究。
研究耐碳青霉烯类鲍曼不动杆菌(CRAB)的基因型特点和与插入序列 ISAbal的关系,探讨其耐药机制。
方法收集CRAB 70株(非重复)和碳青霉烯类敏感鲍曼不动杆菌10株,采用2-巯基丙酸抑制试验检测金属β-内酰胺酶(MBLs);采用多重聚合酶链反应(PCR)扩增 blaIMP、 blaVIM、 blaOXA-23、 blaOXA-24、 blaOXA-51、 blaOXA-58、 ISAbalOXA-23,扩增产物DNA测序进行比对。
结果70株CRAB 2-巯基丙酸与头孢他啶协同试验全部为阴性(即MBLs阴性),用7对特异性引物对70株CRAB和10株敏感菌进行PCR扩增,所有CRAB均携带 blaOXA-23、 blaOXA-51,未检出 blaOXA-24;1株含有 blaOXA-58;80株均不携带 blaIMP和 blaVIM;插入序列 ISAbalOXA-23 70株CRAB均有表达,敏感菌均不表达。
结论CRAB的主要耐药基因是 blaOXA-51和 blaOXA-23;另外, blaOXA-23上游都存在插入序列 ISAbal。鲍曼不动杆菌的耐药性与MBLs、 blaOXA-24、 blaOXA-58无相关性。
To study the relationship between the genotype characteristics and insertion sequence ISAbal of carbopenems-resistant Acinetobacter baumannii(CRAB), and investigate the drug-resistant mechanism.
MethodsA total of 70 strains of CRAB (no repeat strains) and 10 strains of carbopenems-sensitive Acinetobacter baumannii were collected. Metalloenzyme beta-lactamase (MBLs) were detected by 2-mercaptopropionic acid inhibition test. The blaIMP, blaVIM, blaOXA-23, blaOXA-24, blaOXA-51, blaOXA-58 and ISAbalOXA-23 were amplified by multiplex polymerase chain reaction (PCR). The amplified products were measured for DNA sequence.
ResultsThe synergy tests were negative (MBLs negative) by 2-mercaptopropionic acid and ceftazime in 70 strains of CRAB. Through 7 pairs of specific primers, 70 strains of CRAB and 10 strains of carbopenems-sensitive Acinetobacter baumannii were determined for PCR amplification. All the CRAB strains carried blaOXA-23 and blaOXA-51, but blaOXA-24 was never detected. Only 1 strain carried blaOXA-58, and the 80 strains did not carry blaIMP and blaVIM. In addition, all the CRAB strains carried insertion sequence ISAbalOXA-23, however, all the sensitive strains did not carry.
ConclusionsMajor genes are blaOXA-51 and blaOXA-23 in the CRAB strains. Insertion sequence ISAbal is located in the upstream of blaOXA-23. There is no correlation among drug-resistance of Acinetobacter baumannii to MBLs, blaOXA-24 and blaOXA-58.
鲍曼不动杆菌广泛分布于自然界、人体皮肤、口腔黏膜、呼吸道和医院环境中, 为条件致病菌。由于该菌具有很强的环境适应能力和获得外源性耐药基因的能力, 因此极易引起医院感染和菌株耐药[1]。为了解南昌大学第一附属医院耐碳青霉烯类鲍曼不动杆菌(carbopenem-resistant Acinetobacter baumannii, CRAB)的耐药机制, 指导临床合理用药, 防止耐药菌株的蔓延, 我们对临床分离的非重复耐亚胺培南的70株鲍曼不动杆菌和10株对亚胺培南敏感的菌株进行了6种基因以及ISAbal插入序列的研究。
收集2010年1至12月南昌大学第一附属医院各种标本中分离的非重复CRAB 70株, 其中痰标本41株、尿标本19株、血标本10株。菌株全部采用Vitek-2-Compact系统进行菌种鉴定和抗菌药物敏感性试验。大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、阴沟肠杆菌(ATCC 700323)、肺炎克雷伯菌(700603)作为仪器质控菌株。
Vitek-2-Compact系统与配套鉴定卡和药物敏感性卡(法国bio MerieuX公司), 药物敏感性纸片和培养基干粉(英国Oxoid公司), Biometra-Tpersonal聚合酶链反应(PCR)仪(德国), 尤尼柯UV-2800紫外分光光度计(上海), WFH-201B紫外透射仪(上海精科), DYY-6C型稳压电泳仪(北京六一), MDF-382E(N)超低温(-86 ℃)冰箱(日本SANYO公司), 3K15台式低温高速离心机(德国Sigma公司), 细菌基因组DNA提取试剂盒(DP2001离心柱型, 北京百泰先生物技术有限公司), 2-巯基丙酸原液(美国Sigma公司), PCR引物序列(Invitrogen公司), 蛋白酶K-12634020(Roche公司), 溶菌酶-L8120(Solarbio公司), 2* ESYTaq PCR Supermix-AS111以及Trans 2KDNA Marker-Bm101(北京全式金生物技术有限公司), JETQUICK GelExtraction-420050(上海英滩捷基贸易有限公司)。
多黏菌素B和头孢哌酮-舒巴坦最低抑菌浓度(MIC)采用试管稀释法检测, 其他抗菌药物采用仪器检测。药物敏感性试验结果按2010年美国临床实验室标准化协会(CLSI)的标准[2]判断。
采用2-巯基丙酸协同试验。用0.5麦氏浊度单位的待检菌涂布水解酪蛋白琼脂平板, 中间贴一头孢他啶纸片, 距纸片边缘约3 cm处贴一空白纸片, 加2 μ L 2-巯基丙酸原液, 35 ℃培养过夜, 如头孢他啶抑菌环靠近2-巯基丙酸纸片一侧有扩大者, 即为MBLs阳性。
取0.5 mL培养菌液, 15 000× g离心30 s, 弃上清收集细菌。加入200 μ L缓冲液RB重悬洗涤, 15 000× g离心30 s, 弃上清, 将沉淀物振荡。加入200 μ L结合液CB, 立刻颠倒轻摇充分混匀, 再加入20 μ L蛋白酶K(20 mg/mL)溶液, 充分混匀, 70 ℃放置10 min, 冷却后加入100 μ L异丙醇充分混匀。将所得溶液和絮状沉淀都加入一个吸附柱AC中, 15 000× g离心30 s, 弃废液。加入500 μ L抑制物去除IR, 22 000× g离心30 s, 弃废液, 加入700 μ L漂洗液WB, 22 000× g离心30 s, 去废液。吸附柱AC放回空收集管中, 26 000× g离心2 min, 去漂洗液。吸附柱AC放入另一干净离心管中, 在吸附膜的中间部位加100 μ L洗脱缓冲液EB, 室温放置3~5 min, 22 000× g离心1 min, 将得到的溶液重新加入离心吸附柱中, 室温放置2 min, 22 000× g离心1 min。提取的DNA溶液置-86 ℃冰箱保存。
将OXA型碳青霉烯酶基因blaOXA-23-Like、blaOXA-24-Like、blaOXA-51-Like、blaOXA-58-Like和MBLs基因blaIMP和blaVIM引物加入反应体系(总反应体系为50 μ L, 包括引物、pcrmix、DNA模板、双氧水), 优化条件, 具体引物与相应的反应条件见表1。建立多重PCR反应体系。ISAbal插入系列的检测用引物ISAbalOXA-23-Like, 检测blaOXA-23-Like基因上游插入序列ISAbal, 扩增条件同多重PCR。
用三羟甲基氨基甲烷(Tris)-HCl缓冲液配制1%琼脂糖凝胶, 取扩增产物5 μ L和标准物5 μ L, 与2 μ L溴酚蓝指示剂混匀, 水平式电泳槽, 电泳液为Tris-HCl缓冲液, 100 V电压电泳20~30 min, 直至溴酚蓝迁移至胶下游的3/4处, 电泳结束后, 在300 nm紫外灯下观察结果。
| 表1 反应引物及反应条件 |
插入收集管中, 加入500 μ L还原的L2缓冲液, 以14 000× g离心2 min, 弃去流出液,
琼脂糖凝胶溶解, 切下琼脂糖凝胶, 将其转移至EP管中, 每100毫克凝胶加入300 μ L L1溶液, 在50 ℃孵育15 min, 每3 min轻弹管壁或涡旋振荡。柱装填:将JETQUICK离心柱放在2 mL收集管中, 将第1步的混合物上样到准备好的离心柱中, 以14 000× g离心2 min, 弃去流出液, 离心柱的承载量为600 μ L。柱清洗:将离心柱重新
将JETQUICK柱放回原收集管中, 以14 000× g再离心1 min。DNA洗脱, 将JETQUICK离心柱放在另一1.5 mL离心管中, 直接在JETQUICK离心柱硅胶膜的中央加入50 μ L无菌水, 以14 000× g离心2 min。
70株CRAB对多黏菌素B、阿米卡星MIC50和MIC90均较低, 其次是头孢哌酮-舒巴坦, 对其余15种抗菌药物的MIC50和MIC90均较高。见表2。
| 表2 70株CRAB对18种抗菌药物的MIC |
临床分离的CRAB 70株和对亚胺培南敏感株10株, 采用头孢他啶+2-巯基丙酸双纸片法检测, 所有菌株均未观察到协同作用, MBLs筛选为阴性。
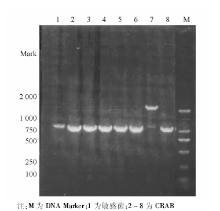
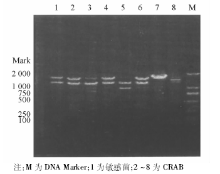
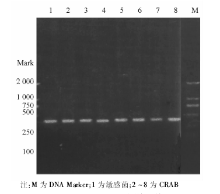
采用特异性引物对70株CRAB和10株敏感菌株进行PCR扩增, 琼脂糖电泳结果显示70株CRAB均携带blaOXA-23、blaOXA-51, 均未检出blaVIM、blaIMP、blaOXA-24; 敏感株中上述基因均未表达。ISAbalOXA-23在CRAB中均表达, 敏感菌株中未表达。blaOXA-58基因在70株CRAB中有1株表达, 敏感菌株中未见表达。具体基因检测结果见图1~3。随机抽取8株blaOXA-23-Like阳性菌株进行产物测序, DNA序列结果与GenBank中的GQ861439.1比较, 同源性达100%。随机抽取8株blaOXA-51-Like阳性菌株产物测序, DNA序列结果与GenBank中的Eu255296.1比较, 同源性达99%。随机抽取8株ISAbal-balOXA-23阳性菌株扩增产物测序, DNA序列结果与GenBank中GQ849192.1比较, 同源性为100%。1株blaOXA-58-Like阳性菌株产物测序, DNA序列结果与GenBank中的CP002522.1比较, 同源性85%。
鲍曼不动杆菌引起的感染以呼吸系统最常见, 这与患者病情重、多有免疫功能低下或缺陷、长期反复使用抗菌药物、接受较多侵袭性操作(机械通气、气管插管、气管切开)等有关。本研究中70株CRAB在各病室的分布以重症监护病房(ICU)最多, 其次为呼吸内科。肿瘤科、高干病房、烧伤科的住院患者中90%也曾在ICU住过或反复应用过抗菌药物或有机体免疫功能低下的特点。
近10余年来国内外对鲍曼不动杆菌的关注程度越来越高, 这不仅仅是因为其在临床上检出率越来越高(仅次于铜绿假单胞菌), 更重要的是因其耐药率的逐年上升, 其所产生的耐药性引发的临床治疗失败以及暴发流行已成为日益严重的公共卫生问题[3]。据2010年卫生部全国细菌耐药监测报告显示, 该菌对亚胺培南和美洛培南的耐药率为53.0%和53.3%, 而江西省为60.6%和68.9%, 南昌大学第一附属医院为65.2%和71.6%, 明显高于全国平均水平。而耐亚胺培南(包括美洛培南)的同时此菌对氨苄西林、氨曲南、环丙沙星、头孢替坦、头孢唑啉、头孢曲松、头孢吡肟、头孢他啶、呋喃妥因、复方磺胺甲口恶唑、哌拉西林-他唑巴坦均耐药。对氨苄西林-舒巴坦、庆大霉素、左氧氟沙星、妥布霉素耐药率分别为91.0%、96.0%、96.0%、80.0%。只有多黏菌素B、阿米卡星、头孢哌酮-舒巴坦效果比较好, 耐药率分别为2.7%、4.3%和37.6%。鲍曼不动杆菌常和多重耐药以及泛耐药联系在一起, 一旦发生耐碳青霉烯类药物, 能用的药物很少, 患者病死率高。面对泛耐药的CRAB感染, 目前只能采用头孢哌酮-舒巴坦、替加环素、多黏菌素B、磷霉素、阿米卡星等治疗。另外, 加强手卫生、早期隔离、控制交叉感染、减少有创操作、缩短机械通气时间、增强免疫力等措施, 对于CRAB感染的防治有着重要意义。
本研究采用金属离子螯合剂抑制方法检测70株CRAB的B类MBLs, 并结合PCR检测blaVIM和blaIMP。上述2种方法均未检出MBLs, 表明南昌大学第一附属医院CRAB耐药机制与MBLs无关。国内报道的鲍曼不动杆菌所产生的碳青霉烯酶主要以D类的blaOXA-23、blaOXA-24、blaOXA-51、blaOXA-58 4种基因为主, 本研究检测的70株中有1株携带blaOXA-58, 此型在国内外只有散在报道[4]。blaOXA-58尽管是质粒介导, 但一般情况下酶活性较低, 只有在高表达时对CRAB的耐药才有影响。本研究结果还显示, 所有菌株均有blaOXA-51表达, 说明南昌大学第一附属医院CRAB的耐药机制与blaOXA-51有关, 不排除有强启动子存在, 导致blaOXA-51的高度表达。blaOXA-51存在于鲍曼不动杆菌的染色体中, 是天然染色体携带基因(固有基因), 而不动杆菌的其他种目前尚未检测到该基因, 此可作为鲍曼不动杆菌与其他种的鉴别依据[5]。本研究70株菌中未检出blaOXA-24, 提示南昌大学第一附属医院CRAB的耐药机制与blaOXA-24无关。70株菌都有blaOXA-23的表达, 说明blaOXA-23是南昌大学第一附属医院CRAB的主要耐药基因, 但其表达与耐药性的相关性如何还要看此菌有无其他耐药机制。另外, 70株菌株中blaOXA-23都存在插入序列ISAbal, 该序列通常存在于耐药基因的上游, 可通过提供启动子、插入失活等方式改变耐药基因的表达水平, 这是鲍曼不动杆菌获得耐药性的重要机制之一[6]。blaAmp C上游ISAbal阳性菌株的表达量明显高于阴性菌株[7]。国内也有报道发现CRAB的blaOXA-23基因上游存在插入序列ISAbal。Turton等[8]研究发现, 插入序列ISAbal在此类基因的表达有着重要的作用, 可能是由于ISAbal位于blaOXA-23上游激活启动子, 使其酶水平表达增强而导致耐药的发生, 还可能与提供了blaOXA-23下游表达的强启动子, 致其过度表达有关。另外, 鲍曼不动杆菌对头孢菌素类(包括1~4代和单环类)、青霉素类、喹诺酮类、呋喃类等抗菌药物为全耐药。从其表型耐药性来看, 似乎与该菌的插入序列(ISAbal)的存在有关, 但两者之间的相关性究竟如何, 还待进一步研究。本研究结果提示, ISAbal与南昌大学第一附属医院CRAB耐药有关。通过对南昌大学第一附属医院鲍曼不动杆菌的耐药性监测和耐药基因的分子生物学研究, 明确了该菌的流行状况与耐药机制, 为科学制定抗感染方案和防止耐药菌的播散提供了可靠依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|