作者简介:林冠峰,男,1988年生,学士,主要从事新型免疫检测技术的研究。
通讯作者:吴英松,联系电话:020-61648321。
利用光激化学发光免疫分析法(AlphaLISA)建立人促卵泡激素(hFSH)的快速检测试剂。
方法使用2株配对的hFSH单克隆抗体,一株hFSH单克隆抗体用生物素标记,另一株hFSH单克隆抗体包被于受体微球上,与包被有链霉亲合素的供体微球共同构成检测试剂,优化反应体系并对试剂的各项性能指标进行评价。
结果自制hFSH试剂分析敏感性和功能敏感性分别为0.09和0.12 U/L,线性测量范围为0.09~192.00 U/L,试剂的分析内变异系数( CV)和分析间 CV分别为4.2%~7.1%和7.5%~8.3%,均<10.0%,与人黄体生成素(hLH)、人促甲状腺素(hTSH) 和人绒毛膜促性腺激素(hCG) 的交叉率分别为0.16%、0.08%和0.02%。100份临床血清样本用本试剂与西门子 Immulite 2000 促卵泡生成激素化学发光(CLIA)检测试剂盒检测,其相关系数为 0.979( P<0.001)。
结论自制hFSH AlphaLISA试剂的各项性能指标均能达到临床检测要求,可用于临床血清样本hFSH浓度的测定。
To develop rapid amplified luminescent proximity homogeneous immunoassay (AlphaLISA) reagent for the detection of human follicle stimulating hormone(hFSH).
MethodsTwo monoclonal anti-hFSH antibodies were used to develop the AlphaLISA reagent for the detection of hFSH. One was biotinylated, and the other was coated on AlphaLISA acceptor beads. The reagent also contained donor beads coated with streptavidin. The optimal test conditions and analytical performance of the method were evaluated.
ResultsThe analytical sensitivity and functional sensitivity of AlphaLISA for the detection of hFSH were 0.09 and 0.12 U/L. The linear measurement range of the developed reagent was 0.09-192.00 U/L. The intra- and inter-assay coefficients of variation ( CV) were 4.2%-7.1% and 7.5%-8.3%, which were all<10.0%, respectively. The ratios of cross-reactivity were 0.16%, 0.08% and 0.02% with human luteinizing hormone(hLH), human thyroid stimulating hormone(hTSH) and human chorionic gonadotropin(hCG), respectively. The results of 100 samples' detection by this reagent showed good correlation coefficient with those of SIEMENS Immulite 2000 follicle stimulating hormone kit by chemiluminescent immunoassay (CLIA, r=0.979, P<0.001).
ConclusionsThe developed hFSH AlphaLISA reagent in this study meets the requirement of clinical determination, and is a valuable test for clinical application.
人促卵泡激素(human follicle stimulating hormone, hFSH) 由垂体前叶分泌, 为单链多肽激素。hFSH 的增高多见于原发性睾丸衰竭、睾丸精原细胞瘤、先天性睾丸发育不全、先天性卵巢发育不全、原发性闭经、原发性性腺功能低下、更年期综合征; 其降低常见于女性不孕症、 长期服用避孕药、大量应用性激素等[1]。目前血清hFSH的检测, 临床上已有时间分辨荧光免疫分析法(TRFIA)[1]、酶标法[2]、磁微粒分离酶联免疫法[3]、放射免疫法[4]、化学发光免疫分析法(CLIA)[5]等。光激化学发光免疫分析法(AlphaLISA)起源于1994年发明的发光氧通道免疫分析(LOCI)技术, 其具有高通量、易自动化、省样本、快速简便、敏感性高、标记物稳定、标准曲线范围宽、不受样本自然荧光干扰及无放射性污染等优点[6, 7, 8, 9, 10, 11]。目前广泛应用于临床的是传统的非均相免疫分析, 如酶联免疫吸附试验(ELISA)、TRFIA, 需要通过洗涤来分离结合标记与游离标记, 存在操作过程步骤多、不易标准化及自动化等缺点。本研究采用AlphaLISA研制hFSH定量检测试剂, 评价各项性能指标, 并与其他检测试剂盒进行比较, 评价其在临床检测应用中的可行性。
2株抗 hFSH 单克隆抗体购自芬兰Medix 公司, hFSH 抗原购自Biodesign公司; hFSH 国家标准品和质控血清为中国药品生物制品检定所产品; 生物素购自于Sigma公司; 受体微球、链霉亲和素化的供体微球(Lot:599675-A)为美国PerkinElmer公司产品; 96孔微孔板为Packard公司产品; 检测仪为美国PerkinElmer公司的2300 EnSpireTM检测仪; 阴、阳性血清样本各50份来自广州市南方医院; 对照试剂盒采用西门子 Immulite2000 促卵泡生成激素CLIA检测试剂盒。
1. 参考标准品的配备 采用标准品缓冲液[50 mmol/L三羟甲基氨基甲烷(Tris)-HCl, 7.5%牛血清白蛋白(BSA)、0.9%NaCl、0.05% NaN3、0.01% Tween-20, pH值7.8]将hFSH抗原配制成0、1、4、16、64、192 U/L系列参考标准溶液, 每瓶1 mL分装冻干, 4 ℃保存备用。
2. 受体微球与抗体连接 将0.2 mg hFSH包被抗体加入到带有滤膜的离心管中, 以5 500× g离心5~6 min, 用标记缓冲液[0.13 mol/L, pH 值8.0磷酸盐缓冲液(PBS)]重复洗涤6次后, 在抗体溶液中加入1 mg受体微球、10 μ L 25 mg/mL NaBH3CN(用标记缓冲液配制)、1.25 μ L 10%Tween-20, 用标记缓冲液将体积补充到200 μ L, 37 ℃避光振荡反应48 h。加入10 μ L 65 mg/mL羧甲氧基胺半盐酸盐(CMO, 用0.8 mol/L NaOH配制)封闭未结合位点, 37 ℃避光温育1 h后离心洗涤, 得到已连接抗体的受体微球, 调整受体微球浓度为5 mg/mL。
3. 生物素与抗体连接 将1 mg 标记抗体加入到带有滤膜的离心管中, 以5 500× g离心5~6 min。用标记缓冲液(0.1 mol/L, Na2CO3/NaHCO3, pH值9.5)重复洗涤6次后, 在50 μ L抗体溶液中加入5 μ L 22 mg/mL生物素[用二甲基亚砜(DMSO)配制], 室温避光振动孵育4 h。利用PBS(pH值7.4)4 ℃透析24 h, 6 h换液1次, 收集透析袋中的液体, 并将其抗体浓度调整为 0.5 mg/mL。
4. 测定方法 将25 μ L标准品或待检测样本加入微孔板中, 并加入以分析缓冲液1∶ 100比例稀释已连接抗体的受体微球25 μ L及1∶ 400比例稀释的生物素化抗体25 μ L, 37 ℃振动温育15 min, 然后由仪器自动加入链霉亲和素化的供体微球175 μ L, 37 ℃振动温育15 min后在2300 EnSpireTM检测仪上检测信号值。
1. 分析敏感性 以零参考标准品测定值的均值加上2倍标准差所得的荧光值扣除本底的荧光值, 代入标准曲线方程计算所得最小测定值的浓度为0.09 U/L。
2. 功能敏感性 将低值样本倍比稀释后重复10次测定, 计算反应量的变异系数(CV), CV> 20%时对应的剂量点为0.12 U/L, 即自制hFSH AlphaLISA检测试剂功能敏感性为 0.12 U/L。
1. 交叉反应 含250 U/L人黄体生成素(hLH)、300 mU/L人促甲状腺素(hTSH)和2 000 U/L绒毛膜促性腺激素(hCG) 样本在本试剂的测定值分别为0.41 U/L、0.24 mU/L 和0.35 U/L, 即交叉率分别为0.16%、0.08% 和0.02%。
2. 干扰试验 向已知浓度的血清样本中分别添加血红蛋白、甘油三酯、胆红素干扰物, 比较测定浓度值和原始浓度值, 结果表明自制hFSH AlphaLISA试剂在检测样本时基本不受血红蛋白、甘油三酯、胆红素的干扰。见表1。
| 表1 自制hFSH AlphaLISA试剂干扰试验结果 |
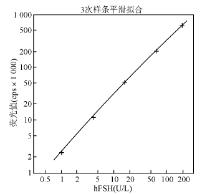
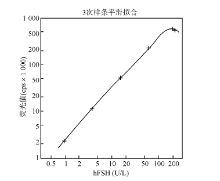
以自制试剂中参考标准品浓度的对数为横坐标, 信号值1× 103计数的对数为纵坐标, 由双对数数学模型Log-Log函数处理, 测得hFSH试剂剂量-反应曲线线性相关系数(r)为0.999 5, 表明自制AlphaLISA检测试剂具有良好的剂量反应线性关系。见图1。
自制hFSH AlphaLISA检测试剂剂量-反应曲线的范围为0.09~192.00 U/L。
1. 正确度 以hFSH 国家标准品为对照品, 自制试剂检测国家标准品的偏差值均在0.900~1.100之间, 正确度良好。见表2。
| 表2 hFSH AlphaLISA检测试剂正确度考核结果(n=10) |
2. 精密度 采用中国药品生物制品检定所提供的低、中、高3个hFSH 质控品(质控品Ⅰ 、Ⅱ 、Ⅲ , 预期浓度分别为5、15、50 U/L)进行测定。结果显示, 自制试剂的分析内CV和分析间CV分别为4.2%~7.1%和7.5%~8.3%, 符合体外诊断试剂检测的要求。见表3。
| 表3 hFSH AlphaLISA试剂分析内和分析间不精密度 |
1. 添加回收率 在5个浓度的hFSH血清样本中添加不同浓度的hFSH纯抗原, 使得血清中hFSH的最终期望浓度为150 U/L, 计算回收率, 结果见表4, hFSH的添加回收率在93.7%~105.7%之间, 表明添加物与血清待测物一致, 基本没有血清基质物的干扰。
| 表4 hFSH AlphaLISA试剂添加回收率试验结果 |
2. 稀释回收率 将3个已知浓度的血清样本用标准品稀释液按1∶ 4、1∶ 8、1∶ 16比例稀释, 比较测定浓度值和真实浓度值, 结果见表5。hFSH的稀释回收率在95.5%~106.5%之间, 表明血清待测物基本没有标准品稀释液基质物的干扰。
| 表5 hFSH AlphaLISA试剂稀释回收率试验结果 |
自制试剂放置4 ℃半年、37 ℃ 7 d后, 各批试剂盒信号值变化不大, 线性关系良好, 且参考标准品A点信号值未见明显升高。
用自制试剂检测血清hFSH的分析敏感性、精确度、稳定性及线性范围的结果, 与西门子CLIA检测试剂盒相比较差异均无统计学意义。100份临床血样同时用自制试剂与CLIA试剂进行平行检测, 结果显示2种诊断试剂的阳性符合率和阴性符合率均为100%。对所测定的数值进行相关性分析, 结果2种方法所得的数值有明显相关性, Y =0.922X-1.444, r=0.979, P< 0.001。见图3。
AlphaLISA起源于1994年发明的LOCI, 是一种通过化学发光检测微球间生物分子相互结合进而测得分析物含量的方法。在680 nm的光照下, 供体微球中的光敏物质受到激发产生单线态氧, 单线态氧扩散至受体微球, 与其中的发光物质反应后产生615 nm的时间分辨荧光[6]。由于单线态氧在溶液中维持活性的时间很短(约4 μ s), 只能扩散约200 nm的距离, 因此只有那些通过待测分析物与供体微球连接在一起的受体微球才能发光[7], 而其他游离的受体微球即使存在于检测体系内, 也将不会发光, 从而可根据发光强度即可得知待测物浓度。二者成双对数线性关系。也就是说, 在供体微球和受体微球大大过量的情况下, 待测生物分子的量与被连接的2种微球的量呈比例。在激发光源(680 nm)的作用下供体微球促使受体微球发光, 因此待测生物分子的量与受体微球的发光强度呈比例关系。从该原理可知, 该技术无需冲洗游离标记物, 与现有的其他检测方法相比较, AlphaLISA因其独特的检测方法, 使其具备时间分辨、均相、不需洗涤等突出特点。
本研究旨在应用AlphaLISA来定量检测人血清hFSH, 自制试剂的分析敏感性为0.09 U/L, 线性范围为0.09~192.00 U/L, 不精密度≤ 8.3%。CLIA检测试剂盒的分析敏感性为0.1 U/L, 线性范围为0.1~170.00 U/L, 不精密度< 7.9%。TRFIA检测试剂盒的分析敏感性为1.0 U/L, 线性范围为1.0~256.00 U/L, 不精密度< 8.5%。本研究结果显示, 自制试剂与CLIA检测试剂盒在分析敏感性、线性范围、精密度等方面无明显差异。本研究研制的试剂可取代进口CLIA试剂盒用于临床检测和基础医学研究。同时与ELISA、TRFIA等试剂盒相比, 该法整个操作时间短(约35 min), 并且在分析敏感性及精密度上有明显优势。因此, 该技术不仅适用常规的需要高敏感性和准确定量的免疫学项目检测, 还可应用于急诊项目的检测。该技术在现在及未来的分析检测领域中将有广阔的发展前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|