作者简介:高 晶,女, 1982年生,学士,技师,从事临床医学检验工作。
探究α2A肾上腺素受体(α2A- AR)、α2B- AR和α2C- AR基因多态性与患冠心病(CAD)的2型糖尿病(T2DM)患者伴无症状心肌缺血(SMI)的关系。
方法采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)和基因测序法对107名正常对照者、129例T2DM伴SMI患者和192例T2DM伴心绞痛患者α2A - AR、α2B- AR和α2C- AR基因多态性进行分析。
结果α2B- AR基因多态性[插入(I)/缺失(D)]的基因型分布与等位基因频率在SMI组和心绞痛组之间均存在明显差异( P均<0.05)。SMI组I/I 基因型频率为34.9%,明显高于心绞痛组(19.8%, P=0.002)。
结论α2B-AR基因多态性I/I基因型与患有CAD的T2DM患者发生SMI有关。
To investigate the relationship of alpha2-adrenergic receptor ( AR) gene polymorphisms (α2A- AR, α2B- AR and α2C- AR genes) with silent myocardial ischemia (SMI) in coronary artery disease (CAD) patients with type 2 diabetes mellitus (T2DM).
MethodsBy polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) and gene sequencing, α2A- AR, α2B- AR and α2C- AR gene polymorphism analysis was performed in 107 healthy controls, 129 T2DM patients with SMI and 192 T2DM patients with angina.
ResultsThe genotype distribution and allele frequencies of α2B- AR gene polymorphism [insertion (I)/deletion (D)] had significant difference between SMI group and angina group ( P<0.05), with genotype I/I frequency being greatly higher in SMI group (34.9%) than in angina group (19.8%, P=0.002).
ConclusionsGenotype I/I of α2B- AR gene polymorphism is associated with SMI in CAD patients with T2DM.
无症状心肌缺血(silent myocardial ischemia, SMI)是指缺乏胸痛或与心肌缺血相关的主观症状情况下心肌缺血[1, 2], 多见于糖尿病(diabetes mellitus, DM)患者, 其发生率为10%~30%[3]。因此, 对患有冠心病(coronary artery disease, CAD)的糖尿病患者进行SMI筛查是十分必要的[4]。α 2-肾上腺素受体(adrenergic receptor, AR)广泛分布于中枢和外周神经系统, 共同参与调节交感系统的多种生理功能, 并与心血管疾病发病和疼痛调节有关[5]。α 2-AR有3种亚型, 即α 2A-AR、α 2B-AR和α 2C-AR[5]。α 2A-AR、α 2B-AR和α 2C-AR的基因依次定位于10、2和4号染色体上, 已发现人类α 2B-AR基因的插入(insertion, I)/缺失(deletion, D)多态性(3个谷氨酸残留物)(rs4066772)在受体第3细胞内环影响脱敏功能[6, 7]。α 2A-AR启动子区域C-1291G 多态性 (rs1800544) 及α 2C-AR基因4个氨基酸缺失多态性 (rs2234888) 分别被报道与神经和心血管疾病相关[8, 9]。然而, 仍未被发现这些遗传变异与SMI的潜在关联, 特别是在DM方面。
为此, 我们对患有CAD的2型DM(type 2 diabetes mellitus, T2DM)伴SMI患者和T2DM伴心绞痛患者的α 2A-AR、α 2B-AR和α 2C-AR基因多态性分布情况进行了分析。
随机选取上海交通大学医学院附属瑞金医院体检中心107名无糖尿病及CAD、无正在使用营养补充剂或药物、肝肾功能和心电图正常者作为对照组, 男72名, 女35名, 年龄51~85岁。选取上海交通大学医学院附属瑞金医院2005年1月至2006年2月心脏内科门诊及住院患者经血管造影证实患有CAD的T2DM患者321例, 其中T2DM伴SMI患者129, 男92例, 女37例, 年龄45~84岁; T2DM伴心绞痛患者192例, 男124例, 女68例, 年龄44~89岁。
CAD诊断依据冠状动脉造影结果。冠状动脉管腔狭窄≥ 70%定义为CAD, 冠状动脉左主干狭窄≥ 50%作为2支血管病变。129例T2DM伴SMI患者在24 h动态心电图检查中有瞬时的无症状ST段压低, 为SMI组。192例T2DM伴心绞痛患者心电图检查符合心绞痛, 并有心绞痛或心绞痛相关事件, 归为心绞痛组。入选患者排除了急性心肌梗死、严重心力衰竭、需要透析治疗的肾功能衰竭、有严重危及生命的疾病或炎症患者。通过C -肽测定排除1型DM患者。本研究经医院伦理委员会批准, 并获得了知情同意书。
1. 生化项目评估 采集禁食8 h以上的空腹血, 分离血清并在-80 ℃冻存。测定血糖、血脂[包括总胆固醇(TG)、甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、脂蛋白(a)、载脂蛋白A1(apo A1)、载脂蛋白B100(apo B100)]和肾功能[包括尿素(Urea)、肌酐(Cr)和尿酸(UA)]水平。仪器为美国贝克曼-库尔特公司全自动LX-20型生化分析仪, 试剂为美国贝克曼-库尔特公司提供的原装试剂盒。
2. 引物设计 应用引物设计软件(美国ABI公司)设计引物, 见表1。
| 表1 引物设计 |
3. DNA提取 使用新鲜血液及DNA提取试剂盒(美国Qiagen公司)来制备基因组DNA。DNA在使用前冻存于-80 ℃。
4. 聚合酶链反应(polymerase chain reaction, PCR)和基因分型 用PCR和限制性片段长度多态性(restriction fragment length polymorphism, RFLP)或测序的方法进行基因分型。PCR反应体系为50 μ L, 包括PCR缓冲液、10 pmol引物、2.5单位Taq DNA聚合酶(美国Promega公司)和0.5 μ g模板DNA。PCR反应条件:94 ℃变性5 min、94 ℃变性60 s、退火60 s、72℃延伸60 s, 经35个循环, 最后于72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳, 先用纯化试剂盒(美国Promega公司)进行纯化, 再使用ABI PRISM 3700 DNA分析仪(美国ABI公司)测序并进行多态性分析。
应用SPSS13.0统计学软件。连续变量用
正常对照组、SMI组和心绞痛组在年龄、性别方面无差异, SMI组和心绞痛组在年龄、性别、吸烟、血压、体重指数(body mass index, BMI)、血脂、肾功能、CAD严重程度及用药方面无差异, SMI组患者罹患T2DM的持续时间高于心绞痛组(P=0.003), 见表2。
| 表2 正常对照组、糖尿病伴SMI患者和心绞痛患者的比较 |
SMI组和心绞痛组基因型分布均符合Hardy-Weinberg平衡。2组α 2B-AR I/D基因多态性基因型分布与等位基因频率差异均有统计学意义(P值分别为0.008、0.037)。SMI组I/I基因型频率(34.9%)显著高于心绞痛组(19.8%, P=0.002), 见表3。2组α 2A-AR C-1291G与α 2C-AR I/D多态性基因型分布及等位基因频率差异无统计学意义(P> 0.05)。正常对照组α 2B -AR基因I/D多态性 D/D、I/D和I/I的基因型频率分别为15.0%、57.9%及27.1%, 与SMI组和心绞痛组比较差异均无统计学意义(P均> 0.05)。α 2A-AR
| 表3 多态性基因型分布和等位基因频率 |
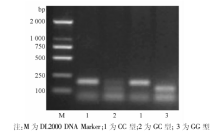
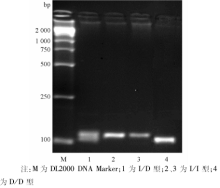
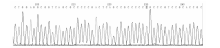
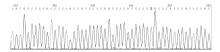
(-1291C/G)多态性位点的RFLP图谱见图1。α 2B-AR(I/D, 301/301) PCR产物琼脂糖凝胶电泳结果见图2。α 2C-AR(I/D, 325/322)DD型测序图见图3, α 2C-AR(I/D, 325/322)II型测序图见图4, α 2C-AR(I/D, 325/322)ID型测序图见图5。
用多变量Logistic回归分析评估DM患者发生SMI的独立危险因素, 包括基因和心血管疾病危险因素。结果显示, 罹患DM的持续时间和α 2B-AR基因多态性的I/I基因型是T2DM患者发生SMI的独立危险因素, 见表4。
| 表4 T2DM患者发生SMI的多变量Logistic回归分析 |
DM患者有65%~80%死于冠状动脉疾病[10, 11]。然而, DM患者SMI产生的机制仍然不明。由于神经病变是DM的主要并发症, 本研究结果显示罹患DM的持续时间是发生SMI的独立危险因素。重要的是, 本研究发现α 2B-AR I/D多态性I/I基因型与DM患者发生SMI有关。对无症状CAD来说, 这可能是一个新的遗传学危险因素的发现。
α 2A-AR、 α 2B-AR和α 2C-AR都有基因多态性。已有研究表明α 2B-AR I/D基因多态性与心血管疾病有关, 其中D/D基因型与CAD急性发作、院前致死性心肌梗死/心源性猝死以及高血压有关[12]。过表达α 2B-AR的D多态性基因虽然不影响配体结合, 但能降低G蛋白偶联受体激酶介导的磷酸化, 造成短期促进激动剂脱敏功能完全丧失[7]。脱敏过程可调节细胞生理状态并应对环境的改变。这些发现表明α 2B-AR基因D多态性在功能调节能力方面较I等位基因差。由此推测在α 2-AR激动剂刺激下, I/I基因型可能更与镇痛作用相关。在DM状态下, 由于交感神经的紧张度增加等因素, 使疼痛的耐受力增加, 这些过程可能加速了DM进展, 并与遗传易感性共同导致DM患者SMI的发生。
α 2A-AR和α 2C-AR基因多态性与神经精神疾病和心血管疾病有关[8, 9]。Leiphart等[13]在发生神经性疼痛的神经组织内发现这2种受体亚型的mRNA表达改变。动物实验表明α 2A-AR、α 2C-AR及α 2B-AR同样和疼痛的感知和调节有关[14]。本研究结果显示α 2A-AR和α 2C-AR基因多态性频率在SMI和心绞痛患者之间差异无统计学意义。这需要更大样本量的研究来确认这些结果。
本研究也存在一些局限性。首先, 目前研究中SMI的检测方法是不够的。从DM患者中筛选出SMI者的方法仍不明确。运动耐力测试、动态心电图记录、负荷超声心动图和计算机断层扫描冠状动脉钙化常常用来检测SMI, 但心肌灌注显像似乎更加准确。其次, 2组样本量相对较小, 因此除α 2B-AR基因多态性之外, 其他基因型和等位基因频率的显著差异较难检出。再次, 本研究中的SMI患者被定义为动态心电图过程中有瞬时无症状ST段压低的CAD患者[15], 而另一些研究则使用压力测试检查。因此, 本研究可能会丢失部分在压力或严重劳累而非休息状态下发生SMI的患者。
综上所述, α 2B-AR基因多态性I/I基因型与患有CAD的T2DM患者发生SMI有关。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|