作者简介:张桂芳,女,1964年生,学士,副主任技师,主要从事临床免疫学检验工作。
探讨乙二胺四乙酸二钾(EDTA-K2)对双抗原夹心酶联免疫吸附试验(ELISA)检测人类免疫缺陷病毒(HIV)抗体的影响。
方法用HIV抗体阴性和阳性静脉血分别制备EDTA-K2浓度为1.5、2.5、5、10、15、20、25、30、35、40 mg/mL的抗凝血并留取无抗凝剂血,分别分离血浆和血清,测定各样本HIV抗体,读取吸光度( A)值,对 A值与EDTA-K2浓度进行相关性分析;制备EDTA-K2最终浓度分别为1.5、2.5、5、10 mg/mL的 HIV抗体阳性和阴性抗凝血各20份并留取无抗凝剂血,分别分离血浆和血清,平行测定各样本HIV抗体,血浆与血清样本进行配对 t检验。
结果EDTA-K2浓度与HIV抗体阴性样本 A值无相关关系 ( P=0.933),与HIV抗体阳性样本 A值呈明显负相关( P<0.01); 当EDTA-K2≥5 mg/mL时,HIV抗体阳性血浆样本 A值明显低于血清样本( P<0.01),当EDTA-K2≤2.5 mg/mL时,血浆与血清样本 A值比较,差异无统计学意义( P>0.05)。
结论EDTA-K2对HIV抗体阴性样本测定无干扰;血浆EDTA-K2≤2.5 mg/mL时,对HIV抗体阳性样本测定无干扰,EDTA-K2≥5 mg/mL时,对HIV抗体阳性样本测定呈明显负干扰。
双抗原夹心酶联免疫吸附试验(ELISA)是人类免疫缺陷病毒(HIV)抗体第3代诊断试剂, 敏感性高, 特异性强, 重复性好, 广泛应用于HIV抗体初筛实验室和献血者血液筛查试验中, 血清或血浆均可作为HIV抗体的检测样本[1]。然而抗凝剂对离体的血液样本是外源物质, 对物质本身或试验过程可能产生多种影响, 导致试验结果失去其真实性[2]。孙立平等[3]曾报道乙二胺四乙酸二钾(EDTA-K2)对HIV抗体阴性样本的影响, 但其应用抗凝剂浓度不适合临床实验室, 而且也未报道抗凝剂对HIV抗体阳性样本的影响。我们系统探讨了EDTA-K2对双抗原夹心ELISA检测HIV抗体阴性和阳性样本的影响, 以指导临床实验室和采供血机构正确选择抗凝剂浓度。
1. 样本来源 HIV抗体阴性样本来自冀中能源峰峰集团有限公司总医院健康体检者; HIV抗体强阳性样本1份来自邯郸市疾病预防控制中心, 经省疾病预防控制中心HIV抗体确认实验室确认, 56 ℃ 30 min灭活处理。
2. 试剂和仪器 HIV抗体第3代(双抗原夹心法)诊断试剂及HIV抗体质控血清(北京万泰有限公司); MULTISKAN MK3型酶标仪(赛默飞世尔仪器有限公司); DEM-3型自动洗板机(北京拓普分析仪器有限公司); 电热恒温水浴箱(上海医疗器械厂)。
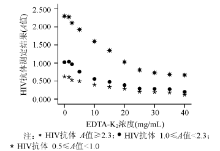
1. EDTA-K2浓度与HIV抗体吸光度(A)值的相关性试验 采集HIV抗体阴性静脉血4份, 其中3份分别加入不同量的HIV抗体强阳性血清混匀, 制备成3份不同程度HIV抗体阳性样本(A值≥ 2.3、1.0≤ A值< 2.3、0.5≤ A值< 1.0)。4份样本均按不同比例分别加入到10支EDTA-K2干粉抗凝管中, 各组血液样本EDTA-K2最终浓度分别为1.5、2.5、5、10、15、20、25、30、35、40 mg/mL, 同时留取血清样本作对照, 测定4组血浆和血清样本的HIV抗体。
2. EDTA-K2抗凝血浆与血清样本的对照试验 采集HIV抗体阴性静脉血40份, 其中20份分别加入不同量HIV抗体强阳性血清混匀, 制备成不同A值的HIV抗体阳性样本。40份样本均按不同比例分别加入到4支EDTA-K2干粉抗凝管中混匀, 使EDTA-K2最终浓度分别为1.5、2.5、5、10 mg/mL, 并留取血清样本作对照, 平行测定各组血浆和血清样本的HIV抗体。
3. 试验操作方法 双抗原夹心法, 按照HIV抗体诊断试剂盒和仪器说明书操作。波长为450 nm、参考波长为630 nm读取A值。以A值/临界值(S/CO)判断结果, S/CO≥ 1为阳性, S/CO< 1为阴性。
采用SPSS 12.0统计软件进行分析。EDTA-K2浓度与HIV抗体的A值进行相关性分析, EDTA-K2抗凝血浆与血清样本的对照试验采用配对t检验, P< 0.05为差异有统计学意义。
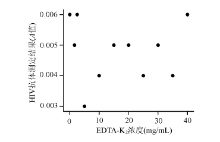
1. EDTA-K2浓度与HIV抗体阴性样本A值的相关性 以EDTA-K2浓度为X轴、HIV抗体A值为Y轴做散点图, 见图1。对A值和EDTA-K2浓度进行相关性分析, 结果显示二者无相关关系(r=-0.029, P=0.933)。
2. EDTA-K2浓度与HIV抗体阳性样本A值的相关性 同上做散点图, 见图2。分别对HIV抗体A值≥ 2.3、1.0≤ A值< 2.3、0.5≤ A值< 1.0的A值和EDTA-K2浓度进行相关性分析, r值分别为-0.965、-0.937、-0.968(P值均< 0.01)。各组A值与EDTA-K2浓度呈明显负相关。
当EDTA-K2浓度≤ 2.5 mg/mL时, HIV抗体阳性血浆与血清样本的A值差异无统计学意义(P> 0.05)。当EDTA-K2≥ 5 mg/mL时, HIV抗体阳性血浆样本A值明显低于血清样本(P< 0.01)。见表1。
| 表1 EDTA-K2抗凝血浆与血清样本检测HIV抗体A值比较 |
抗凝剂是抑制血液凝集的添加剂, 其保证血样中待测成分在进行分析前无明显改变, EDTA-K2通过螯合钙离子完成抗凝功能。实验室检查中使用抗凝血浆既可避免凝血导致的干扰, 也可以减少溶血[2]。但是由于EDTA-K2对离体的血液样本是外源物质, 难免会对试验过程产生各种各样的影响, 从而导致试验结果出现误差。
本研究显示, 在一定范围内, 随着血液样本EDTA-K2浓度的增加, HIV抗体阴性血浆与血清样本的A值无明显差异, 说明EDTA-K2对HIV抗体阴性样本的测定无明显影响。3组HIV抗体阳性样本的A值与EDTA-K2浓度进行相关性分析, 均显示在一定范围内随着血液样本EDTA-K2浓度的增高, HIV抗体A值逐渐降低, EDTA-K2浓度与A值呈明显负相关, 血浆与血清样本配对t检验显示, 当血液EDTA-K2浓度≤ 2.5 mg/mL时, 血浆与血清样本结果差异无统计学意义(P> 0.05)。说明用EDTA-K2作为抗凝剂进行HIV抗体检测时, 浓度在1.5~2.5 mg/mL范围内, 不影响测定结果。当浓度≥ 5 mg/mL时, 血浆HIV抗体A值明显低于血清, 可能会造成弱阳性样本的漏检。
影响抗原抗体反应的主要因素是电解质、酸碱度和温度[4]。EDTA-K2的水溶液pH值为酸性, 随着样本中EDTA-K2浓度的增高, pH值改变也越大, 同时离子强度增大。pH值和离子强度对抗原抗体的理化性质影响较大, 其改变可能导致对ELISA的抑制作用。因而随着EDTA-K2浓度的增加, HIV抗体阳性样本的A值降低。由于HIV抗体阴性样本的本底已经很低, 所以没有显示明显的抑制作用。
优质的试剂、良好的仪器和正确的操作是保证ELISA检测结果准确、可靠的必要条件。要获得稳定、可靠、准确的检验结果, 实验室检验人员要充分考虑ELISA的多种影响因素, 其中较容易被忽略的因素之一是抗凝剂的使用。抗凝剂的使用关系到实验室检验结果的真实性和有效性。如何正确合理选择血液样本类别, 准确规范使用抗凝剂, 是实验室全面质量管理的重要内容[2]。本研究提示, 如果用EDTA-K2作为抗凝剂, 抗凝剂的最终浓度最好选择在1.5~2.5 mg/mL, 其中1.4~1.6 mg/mL是血细胞分析所用抗凝剂浓度[5], 因此对于采集足量静脉血有困难的患者, 可使用血细胞分析样本检测HIV抗体。需要注意, 抗凝剂比例增高, 不仅会对HIV抗体检测造成明显负干扰, 也会影响血细胞分析, 可造成粒细胞完全变性, 淋巴细胞和单核细胞形态改变, 尤其是血小板, 可出现肿胀、破裂而产生碎片, 造成血小板计数结果偏高[5]。因此临床实验室应按照抗凝比例采集样本, 确保检测结果的准确。
由于同一抗凝剂不同浓度对同一厂家试剂HIV抗体检测可产生不同的影响, 同一抗凝剂同一浓度对不同厂家试剂HIV抗体检测也可产生不同的影响[3, 6], 因此实验室欲采用抗凝血浆作为检测样本时, 应与血清样本进行对比试验, 也建议试剂厂家对试剂的抗干扰能力进行严格的质量控制, 说明适合试验使用的抗凝剂及其浓度。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|