作者简介:李玉芹,女,1970年生,学士,主管技师,主要从事医学检验工作。
建立检测抗核周因子(APF)抗体的补体参与的间接免疫荧光两步法(简称补体免疫荧光两步法)并做临床初步应用。
方法以非吸烟、健康、无结缔组织病供者口腔颊部上皮细胞为底物,加入被检者稀释血清,再加入补体,继加入抗补体C3C荧光素,核固红甘油缓冲液封片,在荧光显微镜下观察, 在细胞核的周围,即细胞质中出现大小不等、圆形或椭圆形均质荧光颗粒为阳性,阳性细胞占总细胞50%为APF阳性,做血清补体灭活前后APF检测结果比较。分别检测76例类风湿性关节炎(RA)患者(活动期、缓解期)和61例非RA对照者APF,并与荧光标记检测抗人IgG型APF一步法(简称免疫荧光一步法)比较。
结果血清补体灭活前后APF检测阳性率比较,差异无统计学意义( P>0.05);2种荧光方法检测APF阳性率比较,差异有统计学意义( P<0.05),补体免疫荧光两步法的荧光强度高于免疫荧光一步法,其敏感性为75.0%,特异性为96.7%,阳性预测值为96.6%,均高于一步法;同一RA患者活动期APF荧光强度高于缓解期。
结论补体免疫荧光两步法检测APF提高了分辨率,具有较高的敏感性和特异性,能同时检测IgM、IgA、IgG型抗体,可与类风湿因子(RF)、抗角蛋白抗体(AKA)诊断RA相互补充,提高RA的诊断率。
To establish a complement-meditated indirect immunofluorescence method (two-step method) for detecting anti-perinuclear factor (APF) and apply it primarily.
MethodsThe epithelial cells of oral cheek from non-smoking healthy and non-connective tissue disease subjects were used as substrate. The diluted serum, complement and fluorescent label anticomplement C3C were added. The nuclear fast red-glycerol was performed. By microscopy, the sizes with round or oval homogeneous fluorescent granules in cytoplasm or around the nucleus were as positive. The positive cells accounted for 50% of total cells were regarded as APF-positive, and the results were compared before and after inactivating serum complement. The APF of 76 rheumatoid arthritis (RA) patients at activity and remission periods and 61 controls without RA were determined, and the results were analyzed comparatively with the fluorescent label method (one-step method) for anti-human IgG APF.
ResultsThe positive rates of both methods had no significant differences before and after inactivating serum complement ( P>0.05). The positive rates of the 2 methods were significantly different( P<0.05). Two-step method surpassed the one-step method in sensitivity (75.0%), specificity (96.7%) and positive predictive value (96.6%) which were higher than those of the one-step method. The APF fluorescence intensity in activity period was higher than that in remission period in the identical patients with RA.
ConclusionsTwo-step method can detect APF antibody of IgM, IgA and IgG types simultaneously, and surpasses the one-step method in resolution, sensitivity and specificity. With rheumatoid factor (RF) and anti-keratin antibodies (AKA), they can complement each other in diagnosis of RA and improve the diagnosis of RA.
近年来有研究发现, 抗核周因子(anti-perinuclear factor, APF)、抗角蛋白抗体(anti-keratin antibody, AKA)、抗聚角蛋白微粒蛋白抗体(anti-filaggrinantibodies, AFA)等对类风湿性关节炎(rheumatoid arthritis, RA)的诊断具有特异性[1], 且可用于RA的早期诊断[2, 3]。APF抗原成分是存在于人颊黏膜上皮细胞胞质内的不溶性蛋白质, APF与RA呈良好的相关性, 本研究尝试建立检测APF的补体参与的间接免疫荧光两步法(简称补体免疫荧光两步法), 并做临床初步应用。
1. 研究对象 2007年1月至2009年2月在宝坻区人民医院风湿科门诊或住院的RA患者76例, 男32例, 女44例, 年龄60~82岁, 平均年龄69岁, 病程4个月~5.7年, 平均2.6年。61例非RA对照者, 男28例, 女33例, 年龄61~80岁, 平均年龄67.8岁。全部符合1987 年美国风湿病学会类风湿分会分类标准[4]。
2. 材料 生物薄片来自非吸烟健康无结缔组织病供者。在早晨漱口后, 用无菌海绵小心擦拭两边颊部上皮细胞制成生物薄片, 补体、羊抗人C3C 异硫氰酸荧光素(FITC)、AKA试剂盒均由德国欧蒙公司生产(批号分别为T081020TC、T081020TC和T080930TB)。APF试剂盒由北京和杰创新试剂公司生产(批号为090204); 类风湿因子(RF)检测试剂由英国帮地塞公司生产(批号为266289A), 均按说明书操作。
3. 仪器 EUROSTAR荧光显微镜, 由德国欧蒙公司生产。
1. APF生物薄片的制备 供者在早晨漱口后, 用无菌海绵小块擦拭两边颊部, 放入10 mL pH值7.4的磷酸盐缓冲液(PBS)中, 挤出海绵吸附的细胞, 悬液2 000× g离心5 min, 弃去上清液, 再洗1次, 继续用10 mL PBS-吐温(PBS-T)缓冲液0.5%(V/V)TritonX-100 PBS混悬, 静置10 min, 以2 000× g离心5 min, 用PBS调整细胞数至100个/μ L。点片, 冷风吹干, 密封, -70 ℃低温保存。
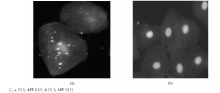
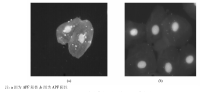
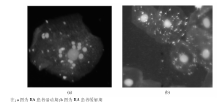
2. APF检测 (1)采用补体荧光两步法检测APF。被检血清样本用PBS缓冲液1∶ 20稀释后, 滴加到抗原片上, 放置1 h, 用PBS缓冲液洗3次, 每次5 min, 加入补体 25 μ L湿盒内37 ℃孵育30 min, PBS漂洗, 吹干, 加入羊抗人C3C FITC 25 μ L, 湿盒内37 ℃孵育30 min, PBS漂洗, 吹干。用含2.5%核固红甘油缓冲液封片。在荧光显微镜10× 40视野下观察5~10个视野, 颊黏膜上皮细胞的核被核固红染成红色, 在核的周围, 即细胞质中出现大小不等圆形或椭圆形均质荧光颗粒为阳性; (2)采用荧光标记检测抗人IgG型APF一步法(简称免疫荧光一步法)检测APF。
3. 补体和活动期的影响 比较血清补体灭活前后APF检测阳性率的差异和同一RA患者活动期与缓解期血清APF荧光强度的差异。
4. 结果判断 在荧光显微镜下观察, 颊黏膜细胞的细胞核呈现橘红色, APF阴性细胞的胞浆均匀清亮无荧光颗粒; APF阳性细胞核周围出现圆形、均质的绿色荧光颗粒, 阳性细胞与颗粒的大小和多少无关。观察同一视野, 阳性细胞占总细胞50%为APF阳性。
5. 方法学评价 分别采用2种测定方法检测76例RA患者和61例非RA对照者APF抗体、AKA及RF。
应用NOSA V3.2统计学软件, 2种方法阳性率比较用χ 2检验, P< 0.05为差异有统计学意义。
将42份血清进行补体灭活前后APF检测阳性率比较, 差异无统计学意义(χ 2=3.62, P> 0.05)。说明血清稀释后, 补体对结果无明显干扰。
在RA组2种方法检测APF阳性率比较, 差异有统计学意义(P< 0.05); 在非RA组2种方法比较, 差异无统计学意义(P> 0.05)。见表1。
| 表1 2种免疫荧光方法检测APF阳性率比较 |
1964年荷兰学者Nienlucis和Mandema用颊黏膜细胞作为底物检测抗核抗体(ANA)时, 偶然发现细胞核周围有均质型的4~7 μ m荧光颗粒, 称之为APF[5]。APF的靶抗原存在于颊黏膜上皮细胞核周胞浆内, 是上皮细胞的中等纤维结合蛋白或其前体, 它是一种不溶性蛋白质。APF主要为IgG, 也含有IgM及IgA成分[6]。
本研究所建立的补体参与的方法是免疫复合物型抗体的检测方法, 使抗原-抗体-补体与荧光素的结合点多且牢固, 提高了分辨率和敏感性。能够同时检测IgG、IgA、IgM等型APF, 减少漏诊率, 为临床提供更为准确的试验结果。GENMED公司的核固红复染试剂是使细胞核呈现淡红色, 从而与组织化学中的样本染色产生色彩差异和对比, 便于观察。用Triton X-100、蛋白酶K等通透液可以溶解细胞膜、细胞核膜、细胞器膜上的脂质而使抗体及大分子结构的物质进入胞浆和胞核内, 与相应抗原结合[7, 8] 。
本研究发现APF主要出现在RA患者血清中, 少见于系统性红斑狼疮(SLE)等非RA的风湿性疾病患者及正常人。APF是一种RA特异性的免疫球蛋白, 以IgG型为主, APF与RA有明显的相关性, 不仅敏感性高(75.0%), 特异性也高(96.7%)。RA患者血液中的特异性IgG、IgA和IgM等抗体与抗原结合形成免疫复合物, 加入补体后参与免疫反应, 补体在代谢过程中产生C3C, 此时加入标记有荧光素的抗C3C抗体, 形成抗原-抗体-抗C3C抗体荧光素标记物, 该复合物固定于载体上, 其他物质漂洗时被洗脱。荧光显微镜下能观察到圆形或椭圆形特异性荧光颗粒。
本研究结果显示, 应用抗补体C3C荧光标记物更适合APF的检测, 其不仅提高了荧光强度, 消除了口腔内细菌产生的非特异性荧光, 弥补了IgM-APF、IgA-APF型抗体检测的不足, IgM-APF、IgA-APF与IgG-APF 3种抗体不能相互替代, 同时检测可相互补充; 该方法能同时检测3种抗体, 诊断特异性可达96.7%, 阳性预测值可达96.6%, 3种抗体对RA的诊断有着重要意义, 与传统的抗人IgG法相比在RA组和非RA组诊断阳性率差异有统计学意义, 本研究方法诊断符合率高于传统法。血清进行补体灭活前后APF检测阳性率比较, 差异无统计学意义(P> 0.05); 同一RA患者活动期血清APF荧光强度高于缓解期。
用于诊断RA敏感和特异的标记物, 应对疾病的严重性进行早期评估, 应是一种非常有价值的临床工具。迄今为止, 只有RF和AFA具有足够的可接受标准(包括抗stratum comeum或AKA和APF)[9]。APF、AKA以及AFA抗体是诊断RA的高度特异性血清学标志物, 能识别各种亚型聚角蛋白微丝抗原决定簇。有人建议, 这些抗体全部被命名为抗聚角蛋白微丝自身抗体。APF、AKA及AFA的检测具有类似的诊断价值。但由于这3个测试不完全重合, APF和AKA组合或AKA与AFA 组合可以提高诊断的敏感性。3个抗原没有一个能全部涵盖抗聚角蛋白微丝自身抗体识别的所有抗原决定簇, 三者相互补充, 可以提高RA的早期诊断率[10]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|