作者简介:闫国超,男,1972年生,硕士,副主任技师,主要从事临床生化检验工作。
观察α-硫辛酸(ALA)对高脂饮食诱导(HFD)的肥胖大鼠血清同型半胱氨酸(Hcy)水平的影响。
方法选择Wistar大鼠50只,随机选10只普通饲料喂养作为普通饲料组,其余40只高脂饲料喂养10周后评价肥胖大鼠模型,成模肥胖大鼠再随机分为2组:HFD组和HFD+ALA组,后者腹腔注射ALA(30 mg/kg)2周。测定各组大鼠血清Hcy、空腹血糖(FBG)、空腹胰岛素(FIns)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、游离脂肪酸(FFA)。采用稳态模型胰岛素抵抗指数(HOMA-IR)计算胰岛素抵抗指数(IRI)结果 高脂饮食10周后成功诱导肥胖大鼠模型32只。与普通饲料组比较,HFD组Hcy、FIns、IRI、TC、TG、HDL-C、LDL-C等明显升高( P<0.05),而FBG、FFA无明显差异( P>0.05)。与HFD组比较,HFD+ALA组Hcy、FIns、IRI、TC、TG、HDL-C、LDL-C、FFA水平明显下降,而FBG无明显差异。HFD+ALA组FFA水平明显低于HFD组及普通饲料组( P<0.05)。
结论高脂饮食诱导的肥胖大鼠血清Hcy水平升高;ALA能够改善高脂饮食诱导的胰岛素抵抗状态,并降低血清Hcy水平。
To observe the influence of alpha-lipoicacid(ALA) on serum homocysteine (Hcy) level in obese rats fed with high-fat diet (HFD).
MethodsA total of 10 rats were selected randomly from 50 Wistar rats, and were fed as a normal forage group, whereas the other 40 rats received a HFD for 10 weeks. Its obese rat model was evaluated, and obese rats were randomly classified into 2 groups: HFD group and HFD+ALA group who were injected with ALA for 2 weeks intraperitoneally at a dose of 30 mg/kg. The Hcy, fasting blood glucose(FBG), fasting insulin(FIns), triglyceride(TG), total cholesterol (TC), high density lipoprotein cholesterol(HDL-C), low density lipoprotein cholesterol(LDL-C) and non-esterified fatty acid(FFA)in serum were determined. The insulin resistance index (IRI) was calculated homeostatic model assessment of insulin resistance (HOMA-IR).
ResultsThe obese rat models of 32 obese rats were obtained after 10 weeks' HFD. Compered to the normal forage group, HFD group gained a higher levels of Hcy, FIns, IRI, TC, TG, HDL-C and LDL-C ( P<0.05). FBG and FFA had no obvious difference between the 2 groups ( P>0.05). Compared to the HFD group, HFD+ALA group had a lower levels of Hcy, FIns, IRI, TC, TG, HDL-C, LDL-C and FFA, and FBG had no obvious difference. FFA levels in HFD+ALA group were significantly lower than those in the HFD group and the normal forage group( P<0.05).
ConclusionsObese rats induced by HFD have a high level of Hcy. ALA can improve insulin resistance,and reduce the serum Hcy level.
肥胖是糖尿病、心脑血管等疾病的重要危险因素, 而同型半胱氨酸(homocysteine, Hcy)已被许多研究证实与心脑血管疾病、外周血管疾病、神经系统退行性疾病、糖尿病、肝硬化、慢性肾病等相关[1]。Hcy通过氧化应激, 可导致内皮细胞和内质网损伤, 破坏机体凝血和纤溶之间的平衡, 使机体处于血栓前状态。我们拟观察高脂饮食诱导(high-fat diet, HFD)的肥胖大鼠血清Hcy的水平及强抗氧化剂α -硫辛酸(α -lipoic acid, ALA)对HFD肥胖大鼠血糖、胰岛素、血脂、Hcy等检测指标的影响。
清洁级8周龄雄性Wistar大鼠50只[购自河北医科大学实验动物中心, 合格证号:1108090, 许可证号SCXK(冀)2008-1-003], 体重为170~190 g。大鼠同室分笼饲养, 每笼5只, 自然光照, 自由进食和饮水。环境温度控制在(23± 2)℃, 湿度60%。适应性喂养1周后按体重随机分为普通饲料组(10只), 高脂饮食组(40只)。普通饲料组给予基础饲料(购自河北医科大学, 热量组成:碳水化合物占65.5%、脂肪占10.3%、蛋白质占24.2%), 高脂饮食组喂以60%脂肪热能的啮齿动物饲料(购自北京博泰宏达生物技术有限公司, 饲料热量组成及具体配方见表1、表2)。
| 表1 动物饲料成分 |
| 表2 动物饲料配方 |
高脂喂养大鼠10周后, 肥胖大鼠判断采用Dobrian的标准[2], obesity-prone(OP)大鼠定义为> 对照组最重大鼠。以普通饲料喂养的普通饲料组中最重的大鼠为判断标准, 高于其体重的高脂饮食组大鼠有32只, 将其再随机分为2组:高脂饮食诱导(HFD)组(16只)和实验组(HFD+ALA组, 16只)。实验组大鼠给予ALA(30 mg/kg)腹腔注射2周, ALA注射液购自亚宝药业太原制药有限公司(批号:110702)。HFD组、NC组给予等量的生理盐水注射, 干预期间继续按原方法喂养。
实验期间每周测体重, 处死前测定体重和身长。断头处死取血后, 留取大鼠脑组织、肝脏、肾脏、胰腺、血管及骨骼肌, 部分取病理, 其余液氮冷冻后备用; 内脏脂肪(肾周脂肪+附睾脂肪)称重后留取部分组织液氮冷冻保存。
1. 仪器 美国贝克曼DXC800全自动生化分析仪、北京核海高科H6003C型放免分析仪。
2. 试剂 血糖试剂为美国贝克曼公司生产, 总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)试剂盒购自德赛诊断系统(上海)有限公司; 游离脂肪酸(FFA)、Hcy试剂购自北京九强公司; 大鼠胰岛素放免试剂盒购自美国LINCO公司。
3. 空腹血糖(FBG)、血脂、Hcy和空腹胰岛素(FIns)测定 大鼠禁食8~10 h, 断头取血, 静置血液15 min, 1 200× g离心5 min分离血清, 贮存在-40 ℃冰箱中备用; 复溶血清后集中测定各项指标, 全程有室内质量控制措施以保证结果准确。采用稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR)计算胰岛素抵抗指数(insulin resistance index, IRI), 计算公式:IRI=胰岛素(μ U/mL)× FBG(mmol/L)÷ 22.5。
采用SPSS 12.0统计学软件进行数据处理。采用ANOVA分析, P< 0.05表示差异有统计学意义。
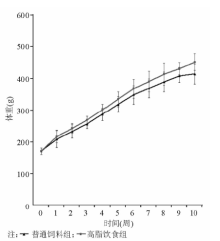
喂养后普通饲料组、高脂饮食组Wistar大鼠前10周的体重变化见图1。采用Dobrian的标准, 成模大鼠共32只, 成模率80%, 平均体重为(440.2± 14.6)g。分组处理后, HFD组体重继续缓慢增加, 12周后的末期体重为(457.6± 12.5)g; HFD+ALA组体重缓慢下降, 末期体重为(426.5± 13.7)g; 普通饲料组末期体重为(423.0± 12.0)g。HFD组的体重、内脏脂肪、内脏脂肪/体重明显高于普通饲料组和HFD+ALA组(P< 0.05、P< 0.01)。见表3。
| 表3 Wistar大鼠的一般情况 |
与普通饲料组比较, HFD组Hcy、FIns、IRI、TC、TG、HDL-C、LDL-C水平明显升高(P< 0.05), 而FBG、FFA水平差异无统计学意义(P> 0.05); 与HFD组比较, HFD+ALA组的Hcy、FIns、IRI、TC、TG、HDL-C、LDL-C、FFA水平明显下降(P< 0.05), 而FBG水平差异无统计学意义(P> 0.05)。HFD+ ALA组FFA水平明显低于HFD组及普通饲料组(P< 0.05)。见表4。
| 表4 3组大鼠血清检测项目结果比较 |
在饮食诱导的肥胖、代谢综合征动物模型的研究中, 由于自制高脂饲料的配方、热量组成不同, 口味各异, 甚至导致饲养后越喂越瘦的现象发生; 而纯化饲料具有组成清楚、成分公开、变动性小等优点, 便于不同的研究结果比较及研究成果的分析, 尤其在寻查病因、药效评价方面具有重要意义[3]。因此本研究采用了无遗传背景的Wistar大鼠, 应用国际研究通用的60%脂肪热能啮齿动物饲料配方成功诱导了肥胖大鼠模型, 表现为体重增加(肥胖)、内脏脂肪显著升高、存在胰岛素抵抗和血脂异常。实验模型更接近于人类的高能量摄入, 并更具可比性和良好的重复性, 可很好的模拟人类不健康的生活方式[4, 5]。本研究发现腹腔注射ALA(30 mg/kg)后, Wistar大鼠的进食量明显减少, 体重缓慢下降, 而接受腹腔注射生理盐水的普通饲料组及HFD组大鼠体重继续增加。Kim等[6]认为ALA显著降低啮齿类动物体重的原因主要是由于减少了动物的进食, 其机制是ALA下调了下丘脑内AMP-激活的蛋白激酶(AMPK)的活力。腹腔注射ALA后并未影响大鼠的血糖水平, 但胰岛素抵抗明显减轻, 其机制是单纯由体重下降、内脏脂肪减轻引起, 还是增加了外周组织利用葡萄糖的利用, 仍待进一步研究。
从本研究结果可以看出, HFD+ALA组与HFD组相比, 血脂各项指标均有下降。值得关注的是, HFD+ALA组的FFA水平低于普通饲料组及HFD组, 这可能与ALA增强脂肪酸的氧化供能有关。HFD+ALA组与HFD组相比, FBG无明显差异, 但HFD组FIns水平明显升高, 2组HOMA-IR也有明显差异, 表明高脂饮食组大鼠存在胰岛素抵抗, 而ALA可明显改善大鼠机体的胰岛素抵抗状态。
本研究结果证实高脂饮食导致大鼠肥胖动物模型的血清Hcy浓度增加, 与杨国庆等[7]的结果一致。杨国庆等[7]认为高脂饮食诱导的胰岛素抵抗与大鼠血浆Hcy水平升高有关, 胰岛素可能通过调节参与蛋氨酸循环中重要酶的活性从而影响血浆Hcy水平; 体外研究发现增加血糖和胰岛素后, HEP G2细胞亚甲基四氢叶酸还原酶(MTHFR)活性增加, 而胱硫醚β 合酶(CBS)的活性下降。Bravo等[8]利用高脂饮食诱导非酒精性肝炎模型, 发现肥胖的Wistar大鼠出现高Hcy血症, 其转硫通路受到影响, 肝内负责将Hcy分解为半胱氨酸的转硫途径中的2个关键酶— — CBS、胱硫醚γ 裂解酶(CGS)活性下降, 血浆半胱氨酸(Cys)水平也下降, 而参与肝脏蛋氨酸代谢的甲基转移酶类活性没有变化。临床上对高Hcy血症的干预主要针对Hcy代谢途径, 给予补充叶酸和B族维生素等药物治疗。新近临床发现复合抗氧化剂(N-乙酰半胱氨酸、硫辛酸、α -生育酚)能降低老龄大鼠脑组织中Hcy的浓度[9], ALA作为已知最强抗氧化剂, 其抗氧化应激作用毋庸置疑, 那么ALA对代谢的影响是否影响Hcy的浓度水平?临床有ALA对2型糖尿病早期肾病患者高Hcy血症影响的报道[10, 11]。本研究初步的结果表明ALA可降低高脂饮食诱导的肥胖大鼠模型体内Hcy的浓度; 关于ALA如何影响蛋氨酸循环、Hcy代谢尚无报道。故有待进一步扩大动物模型批次验证并深入探讨其影响机制。
在Hly所诱导的组织损伤中, 氧化应激是其中最重要机制之一[12]。目前认为氧化应激是肥胖和糖尿病、心脑血管等疾病发生、发展的共同机制, 高Hcy水平引起的氧化应激在糖尿病血管病变、神经病变和胰岛β 细胞的损伤中起重要作用。多项流行病学研究显示肥胖者体内存在氧化应激, 许多细胞内的信号传导通路对氧化应激都很敏感, 氧化应激被认为是上述疾病的“ 共同土壤” [6]。高Hcy水平引起的氧化应激与血管内皮损伤、血栓形成、脂质代谢、胰岛β 细胞的损伤、炎性反应等密切相关, 从而导致心脑血管疾病的发生[13]。Hcy通过多种途径损伤血管(损伤血管内皮细胞、刺激血管平滑肌细胞生长), 破坏正常凝血机制, 增加血栓形成引起心脏病发作及中风。Hcy可促进脂质沉积于动脉壁, 使泡沫细胞增加; 还可改变动脉壁糖蛋白分子纤维化结构, 促进斑块钙化。Hcy水平的升高还会影响体内许多物质的甲基化过程, 甲基化能力的降低影响细胞的发育及分化[14]。因此以提高机体抗氧化能力来防治肥胖相关疾病是值得尝试和探索的的途径。
总之, 本研究发现ALA可直接影响大鼠的食欲, 降低体重及内脏脂肪; 通过其抗氧化应激、促进脂肪氧化功能, 提高了胰岛素敏感性; 同时降低了动物体内Hcy水平, 对肥胖大鼠模型产生保护作用[15], 其详细机制尚待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|