作者简介:柳文菊,女,1971年生,学士,主管技师,主要从事分子生物学研究。
通过多种方法比较分析找到一种高灵敏的检测乙型肝炎病毒(HBV)YMDD变异的方法。
方法收集抗病毒治疗1年的慢性乙肝患者样本166例(116例采用拉米夫定治疗、50例采用替比夫定治疗),比较高温连接酶检测反应(LDR)、实时荧光聚合酶链反应(Real-time PCR)和测序3种方法检测HBV YMDD变异灵敏性。
结果LDR、Real-time PCR、测序的阳性率分别为23.49%、21.68%、19.27%。3种方法的特异性均为100%。采用拉米夫定治疗的患者中有38例变异,其中YIDD12例、YVDD26例;替比夫定只有1例YIDD变异。
结论LDR方法检测YMDD变异是非常适合临床应用的方案。YVDD变异较YIDD变异更为普遍。
To analyze comparatively and find a sensitive detection method for hepatitis B virus (HBV) YMDD mutation.
MethodsA total of 166 samples from patients with HBV infection were collected, including 116 cases treated by lamivudine for 1 year and 50 cases treated by telbivudine for 1 year. The comparison of 3 HBV YMDD mutation detection methods real-time polymerase chain reaction (PCR),high temperature ligase detection reaction(LDR) and sequencing was analyzed. In addition, the sensitivities of the 3 methods were detected.
ResultsThe positive rates of LDR, real-time PCR and sequencing were 23.49%, 21.68% and 19.27%. The specificities of the 3 methods were 100%. In the cases treated by lamivudine, there were 38 cases with mutation (12 YIDD and 26 YVDD). There was only 1 case with YIDD mutation in the cases treated by telbivudine.
ConclusionsThe LDR for detecting YMDD mutation is suitable in clinical application, and YVDD mutation is more common than YIDD mutation.
乙型肝炎是由乙型肝炎病毒(HBV)引起的严重威胁人体健康的病毒性传染病之一。中国约有1亿人携带HBV, 3 000万人为慢性乙型肝炎(简称乙肝)患者, 且5%~10%慢性乙型肝炎患者有可能转化为肝硬化或肝癌[1]。拉米夫定和替比夫定通过抑制HBV逆转录酶活性, 阻止病毒核酸的复制, 显著降低HBV DNA载量[2, 3]。但长期应用上述2种药物, 可引起HBV基因变异而导致耐药, 从而影响治疗效果或加重病情。研究发现YMDD(酪氨酸-蛋氨酸-天门冬氨酸-天门冬氨酸)变异是引起拉米夫定和替比夫定耐药的主要原因, YMDD变异是第552例蛋氨酸(M)被缬氨酸或异亮氨酸(I)所取代, 变成M552V或M552I, 即rtM204I/V[4, 5]。本研究采用连接酶检测反应技术(LDR)、实时荧光定量聚合酶链反应(Real-time polymerase chain reaction, RT-PCR)技术和测序3种方法进行YMDD变异检测, 以期确定最适用于临床的检测方案, 并初步探讨拉米夫定和替比夫定治疗过程中可能出现的YMDD变异类型。
收集2009年至2010年在荆州市第一人民医院进行抗病毒治疗的乙肝患者样本166例, 其中116例患者服用拉米夫定治疗1年, 50例患者用替比夫定治疗1年。男97例, 女69例, 年龄37~58岁; HBeAg(e抗原)阳性患者135例, 抗HBeAg阳性31例, 平均丙氨酸氨基转移酶(ALT)水平为(76.8 ± 57.1)IU/L, 平均HBV DNA 水平(log10拷贝/mL)为5.82。本研究中乙肝特征为:(1)乙型肝炎表面抗原(HBsAg)阳性, 且至少6个月; (2)血清HBV DNA> 10 000拷贝/mL; (3)ALT水平升高或反复升高。患者血清分离后-70 ℃保存备用。
SLAN荧光定量PCR仪(上海宏石公司); LightCycler 1.0荧光定量PCR仪(罗氏公司); MJ-90 PCR仪(美国伯乐公司); ABI3130测序仪(美国ABI公司); 迪瑞生化仪(深圳迪瑞公司)。
1.HBV DNA定量检测 采用SLAN实时荧光定量PCR仪检测, 试剂由上海复星医学科技发展有限公司提供。按照HBV DNA定量试剂盒说明书进行。取血清100μ L加入等量DNA提取液A, 混匀后14 300× g离心10 min, 去除上清后加50μ L DNA提取液B, 混匀后100 ℃煮沸10 min, 离心后取上清即为总HBV DNA。提取产物做实时荧光 PCR, 由标准曲线计算出HBV DNA的定量浓度值。
2.YMDD变异检测 RT PCR采用上海复星医学科技发展有限公司的乙型肝炎病毒YMDD基因变异检测试剂盒(PCR荧光法), 样本提取同HBV DNA定量, YMDD分3管检测, 同时测定HBV总DNA、YIDD变异和YVDD变异。LDR采用上海医学科技发展有限公司提供的乙型肝炎多耐药变异检测试剂盒(LDR法); DNA的提取方法同HBV DNA定量, PCR扩增和LDR反应在MJ-90PCR仪器完成, 由ABI3130对结果进行检测, GeneMapper分析软件对检测结果分析。YMDD测序的引物提供给Invitrogen公司合成并完成测序, 测序引物如下:5'-CATTTGTTCAGTGGTTC GTA-3'; 5'-CAAAAGAAAATTGGTAACAGCGGTA-3'。PCR条件为:94 ℃ 4 min, 35个循环, 94 ℃ 10 s; 60 ℃ 45 s; 72 ℃ 1 min。PCR产物送Invitrogen做测序, 测序结果在NCBI上分析。融解曲线方法鉴定YMDD的引物探针为peimer:5'-CCCCCAATACCACATCATC-3'; peimer I:5'-CCC AATACCACATCATCCAC-3'; peimer V:5'-CCCCCA ATACCACATCATCG-3'; Forwaed peimer:5'-CCTATG GGAGTGGGCCTC-3'; Probe:5'-FAM-ACTTCCGTCT CGTGCTCCTCA-TAMRA-3'。LightCycler1.0反应条件为:94 ℃ 4 min, 94 ℃ 10 s和60 ℃ 45 s, 45个循环; 之后快速升温至94 ℃, 再降温至37 ℃ 5 min, 再按0.2 ℃/s缓慢升温至72 ℃。YMDD、YIDD和YIDD的融解温度峰值分别为(50± 1.5)℃、(42± 1.5)℃、(60± 1.5)℃。
3.免疫标志物检测 乙型肝炎表面抗原(批号20090328)和e-抗体(批号20090401)的检测试剂由上海科华生物有限公司提供。
应用SPSS11.0统计软件对实验数据进行t检验分析, P< 0.05表示差异有统计学意义。
166例血清样本中RT-PCR检测到36例YMDD变异, LDR检出39例YMDD变异, 测序法检出32例YMDD变异, 检出阳性率分别为21.68%、23.49%和19.27%, 结果见表2。
| 表2 3种方法检测YMDD阳性率比较 |
RT-PCR、LDR和测序3种方法对5例YMDD样本和5例YMDD野生型样本的检测特异性, 均为100%。
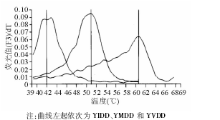
应用LDR方法有7例YMDD阳性样本测序方法并没有检测, 这些样本采用融解曲线的方法鉴定。得到4例YIDD和3例YVDD, 与LDR方法一致。结果见图2。
采用拉米夫定治疗1年的患者中有38例出现变异, 变异率为32.76%, 其中YVDD 26例(68.42%)、YIDD 12例(31.58%), 二者比较差异有统计学意义(P< 0.05)。替比夫定的变异只跟YIDD相关, 50例样本中只出现1例变异, 变异率为2%。
| 表4 不同药物的变异结果 |
近年来出现了多种乙肝病毒YMDD变异的检测技术, 不同方法在特异性及灵敏性方面存在着一定的差异。本研究讨论了3种检测YMDD变异的技术, 包括PCR 产物直接测序法、RT-PCR和LDR。
测序是检测乙肝病毒YMDD变异的常用方法。本研究166例样本测序, 获得32例变异株, 阳性率是19.27%, 但测序是3种方法中灵敏度最低的一种。原因是当变异株占总病毒株比率偏低时(< 20%), 难以对变异株进行准确检测, 因为PCR扩增的竞争抑制作用导致了优势株的信号掩盖了非优势株的信号, 从而造成检验结果的误差[6]。PCR直接测序法可以用于核苷类药物出现的耐药检测, 但对于变异株较少临床样本, 该检测方法的灵敏度不够。 因此, PCR直接测序法还不能成为临床实验室的常规技术。
Taqman荧光定量技术有特异性好、灵敏度高、线性关系好、操作简单、自动化程度高、防污染等优点。166例样本分析中, 应用Taqman荧光定量得到36例变异样本, 比测序方法多检测出1例, 检测的阳性率是21.68%。目前此方法在临床应用较多。
LDR是一种新兴的单核苷酸多态性(SNP)分型检测方法。其原理是高温连接酶检测到模板DNA与2条探针DNA的接头处存在着碱基错配, 则连接反应不能进行; 即如果探针与模板有1个碱基不配对, 连接反应不能进行, 如果探针与模板完全互补, 连接反应完成。与其他检测技术相比, LDR检测技术拥有准确度高、通用性强、通量大、操作简单、成本低等众多明显优势[7]。在本研究中, 应用LDR技术从136例乙肝患者样本中检出39例YMDD变异样本, 阳性率接近23.49%, 其中几例103~104/拷贝的样本其他2种方法均没有检测到变异。因此它是3种方法中灵敏度最高的一种, 尤其是对于低滴度样本。
拉米夫定是第一个批准用于治疗慢性HBV感染的胞嘧啶核苷类似物, 其作用机制是抑制具有逆转录活性的HBV DNA聚合酶, 中止HBV DNA链的延长, 有效抑制HBV的复制。 但是, 长期使用拉米夫定可发生耐药。乙肝病毒发生YMDD变异后, 改变了HBV DNA聚合酶的亚结构, 减少了拉米夫定与该酶的结合, 造成HBV对拉米夫定的耐药。 本研究116名患者服用拉米夫定1年, 共有39例出现YMDD变异, YIDD和YVDD的例数分别为13例和26例, 变异率分别为34.21%和63.79%, 二者比较差异有统计学意义(P< 0.05); 与其他文献结果基本一致。替比夫定是一种新型的用于治疗慢性乙型肝炎的左旋核苷类似物, 2007 年2 月被批准用于治疗乙型肝炎, 现已在临床上广泛应用。替比夫定耐药只跟YMDD变异中的YIDD变异相关, 大量文献报道替比夫定1年的耐药率< 5%, 本研究结果为2%, 二者基本一致。
另外需要指出的是, 受检测方法对变异毒株检出效能的限制, 只有变异毒株超过总毒株量约1/15时, 才能准确地给予变异株检测。因此, 通过改善相关技术的特异性, 从而可进一步提高其灵敏性, 以提高YMDD自然变异检出率。由于YMDD变异还有2种少见变异类型, 实际检测中会出现此型的漏检, 因此在检测系统中补充这2种变异类型的检测将会使该方法更加完美。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|