作者简介:罗曼,女,1963年生,博士,教授,主要从事生物化学与分子生物学及生物物理方向。
为实现对健康人群进行日常的无创血糖监测,构建基于唾液的高灵敏度葡萄糖检测体系。
方法通过对反应体系最适pH值、离子强度的筛选及酶活性调节剂柠檬醛的添加,对以2,4,6-三溴-3-羟基苯甲酸(TBHBA)为色原的葡萄糖氧化酶法进行改良。
结果新构建的葡萄糖检测体系反应30 min趋于完全,在510 nm 最大吸收波长下检测吸光度(
优化后的检测体系灵敏度是原体系约7倍,检测低限为健康人空腹时唾液葡萄糖平均浓度的1/10,完全达到检测健康人唾液葡萄糖浓度的灵敏度要求。
To establish a high sensitive detection system to detect the glucose level in saliva in order to realize the daily noninvasively blood glucose monitoring for healthy subjects.
MethodsThe method of glucose oxidase-peroxidase with 2,4,6-tribromo-3-hydroxybenzoic acid(TBHBA) as chromogen was modified, in which pH value and the consistency of ion were optimized, and citral was added to adjust the activity of the enzyme.
ResultsThe reaction of the new detection system could be completed in 30 min, and the maximal absorbing wavelength of detecting absorbance (
The sensitivity of the optimized detection system is about 7 times more than that of the original system. The low limit value is 1/10 of fasting saliva glucose mean level in healthy subjects. It is sensitive enough to detect the glucose level in saliva of healthy subjects.
随着人们防未病意识的逐步提高,通过对日常生理指标的监测来进行正常人健康状况的预测和疾病的预知是非常必要的。近些年研究常通过唾液里面的成分对临床生理指标进行无创检测或监测。有报道[ 1, 2]发现“正常人唾液葡萄糖浓度与血液葡萄糖浓度成显著相关性”,这一观点得到了普遍认同;又有报道[ 3]发现正常大鼠的血糖存在昼夜节律变化,而糖尿病大鼠的血糖昼夜节律调节紊乱。据此得出“正常人唾液葡萄糖浓度变化的周期应与血糖变化周期密切关联”的推断。在上述基础上,本项目目标是“将唾液葡萄糖水平周期性变化作为与血糖关联的人体生理信号”,通过对健康人唾液葡萄糖水平的日常采集、数据挖掘等分析,获得群体或个体健康状况下唾液葡萄糖周期变化规律,用于判断日常所采集的唾液葡萄糖生理信号异常与否,为对受试者健康状态进行评价和对糖尿病早期预知提供参考依据。我们参考了文献[4-5]的检测体系,采用了相同的高灵敏度色原剂2,4,6-三溴-3-羟基苯甲酸(TBHBA),但为实现对健康人唾液葡萄糖进行日常监测,我们对该检测系统的组分和配伍及反应条件进行研究,以提高检测灵敏度满足对更低浓度唾液葡萄糖浓度的检测。为最大程度发挥酶活性和提高终产物稳定性,我们从反应体系的pH值、离子浓度及酶活性调节剂等方面进行研究,以筛选出最佳组合,使检测体系达到对健康人群唾液葡萄糖浓度检测的要求。
SynergyTM4多功能酶标仪(美国BioTek公司);QYC-200全温空气摇床(上海福玛设备有限公司);DELTA 320 pH计(中国Meitler Toledo公司);BS 124S电子天平(赛多利斯科学仪器有限公司);80-L离心机(常州市华普达教学仪器有限公司)。
96孔板、葡萄糖氧化酶(GOD,货号G7141)、过氧化物酶(POD,货号P-8375)、4-氨基安替比林(货号33528)、TBHBA(货号439533)、葡萄糖(货号G7528)均由美国Sigma公司提供;柠檬醛AR级(货号27450)由Sigma Fluca公司提供,CR级(货号S28189)由Sigma Aldrich公司提供;0.2 mol/L磷酸缓冲液(PBS)、NaCl(AR级,国产)。
1. 葡萄糖溶液的配制 精确称取0.04 g葡萄糖以三蒸水溶解,并移入50 mL容量瓶中,稀释至刻度得4.4 mmol/L葡萄糖标准溶液,以母液稀释至所需液度母液,再稀释10倍得到0.44 mmol/L葡萄糖样本溶液,置4 ℃保存待用(溶液均于实验前一天新鲜配制,4 ℃静置使之变旋平衡且不变质)。
2. 酶反应检测液的配制 0.25 mkat/L GOD、0.17 mkat/L POD按产品说明书配制为1 mg/mL贮存液,分装冻存于-20 ℃,每次实验取适量,以PBS稀释至所需浓度;4-氨基安替比林(0.5 mmol/L)、TBHBA(5 g/L)以PBS溶解配制。
3. 葡萄糖浓度测定 在96孔板中每孔加入20 μL样本、250 μL酶反应检测液,37 ℃振荡温育后,立即在-20 ℃冷却5 min,再于4 ℃静置 10 min;在酶标仪上检测吸光度( A)值。每个样本设3组平行。
4. 检测波长选择 在500、505、510、515、520 nm波长下对同一样本检测其 A值,比较并选择最大吸收波长。
5. 检测体系作用时间选择 对同一酶反应检测体系的样本组和对照组(样本替换成同体积的三蒸水)温育30、40、50、60 min,在510 nm下检测0.044 mmol/L葡萄糖样本 A值,比较得出最适反应时间。
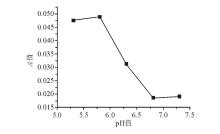
6. pH值筛选实验 配制pH值分别为5.3、5.8、6.3、6.8、7.3的PBS;设置样本组和对照组;在不同pH值的检测体系中加入0.44 mmol/L葡萄糖样本,检测样本组和对照组的 A值,步骤同“3.葡萄糖浓度测定”;样本 A值 = 样本组 A值-对照组 A值。
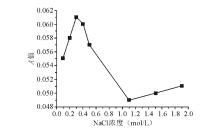
7. NaCl浓度筛选实验 配制NaCl浓度分别为0.1、0.2、0.3、0.4、0.5、1.1、1.5、1.9 mol/L的0.2 mol/L PBS(pH值 5.8);设置样本组和对照组,以0.44 mmol/L葡萄糖为样本,其余同“3.葡萄糖浓度测定”。
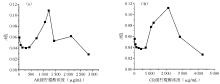
8. 柠檬醛对检测体系影响的研究 (1)配制71、142、284、426、710、1 065、1 220、1 420、2 130、2 840 μg/mL 的一系列浓度柠檬醛(AR级)(柠檬醛和甘油按体积比4∶1混合,加入PBS稀释至所需浓度)添加到酶反应检测液(pH值 5.8、0.3 mol/L NaCl)中;同时设置不添加柠檬醛的零试剂组;都设置样本组和对照组;以0.044 mmol/L葡萄糖样本,葡萄糖浓度测定同“3.葡萄糖浓度测定”;(2)配制714 260 μg/mL的一系列浓度柠檬醛(CR级),重复上述实验。
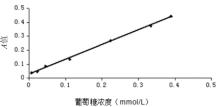
9.新构建体系检测葡萄糖浓度线性范围的确定 采用新构建的pH值5.8、NaCl浓度为0.3 mol/L、添加1 220 μg/mL柠檬醛的酶反应体系检测浓度为0.006、0.022、0.044、0.11、0.22、0.33、0.39 mmol/L葡萄糖标准溶液的 A值,检测步骤同“3.葡萄糖浓度测定”。所得结果绘制成标准曲线。
同一样本的3个平行组数据采用
葡萄糖浓度检测体系反应产物在510和515 nm波长下测得 A值均为0.116;在505 nm波长下测得 A值为0.115;500和520 nm波长下测得 A值为0.114。结合文献[4-6]所采用的波长(505 nm),本研究选择与其相近且为最大吸收波长的510 nm作为检测波长。
检测体系反应30 min时测得 A值为0.048,随温育时间每延长10 min,测得样本 A值分别为0.045、0.044、0.042。由此可见,随反应时间延长,产物生产量非但没有增加而呈低幅降低(约4.4%)趋势,说明酶促反应作用至30 min即达到反应终点, A值随时间延长而减小很可能是副反应增多而降低的缘故。因此本研究选择30 min作为酶促反应时间。
pH值筛选结果见 图1。 A值-pH值曲线呈“斜体Z字”走势,pH值为5.8和6.8时 A值分别为最大值和最小值,二者 A值之比约为2.6。环境pH值会改变或影响酶和底物的解离状态而增加或降低酶活性。因此,酶发挥最大活性需要相应的最适pH值。在检测液中主要催化酶为GOD和POD,前者活性范围在pH值4.0~7.0,后者活性范围在pH值5.0~9.0。实验测得的反应检测液最适pH值为5.8,既在GOD活性范围内又在POD活性范围内。因此,从理论上推测,pH值 5.8为2种酶所在同一体系的综合最适环境pH值也是合理的。pH值5.8时所对应的 A值是pH 值7.0时的2.6倍左右,即优化反应体系pH值后,检测灵敏度提高了约1.6倍。
NaCl浓度对终产物红色醌亚胺生成量的影响见 图2。当NaCl为0.3 mol/L时, A值最大(产物量最多),高于或低于0.3 mol/L时, A值均下降。0.3 mol/L NaCl的 A值是1.1 mol/L时的1.27倍,是0.154 mol/L时的1.13倍。与原反应体系相比,将NaCl浓度由0.153 mol/L上调至0.3 mol/L时,样本 A值将提高至1.13倍。
产物生成量 A值与柠檬醛浓度之间的相关性见 图3。该曲线由10个点数据拟合而成,X轴的柠檬醛浓度呈倍数递增(1、2、4、6、10、15、17、20、30、40倍)。AR级柠檬醛样本的实验结果见 图3(a)。曲线外形似倒“V”字型,有一最大值,在其两侧有一随浓度增大而 A值增大的上升支和随浓度增大而 A值减小的下降支。与对照组 A值比较,对应上升支和下降支两端均存在一浓度区间(71~426、1 420~2 840 μg/mL),其对应的 A值均低于对照组,如71 μg/mL柠檬醛所对应的 A值较对照组下降23.7%,2 840 μg/mL柠檬醛所对应的 A值较对照组下降53.7%;但在710~1 420 μg/mL浓度区间,各柠檬醛浓度所对应的 A值均高于对照组,若1 220 μg/mL柠檬醛所对应的 A值为最大值,约为对照组的2.2倍。
图3(b)是CR级柠檬醛样本的实验结果。从柠檬醛浓度与终产物 A值的函数关系曲线的整体变化走势来看,与AR级柠檬醛的结果类似[图(a)],不同的是曲线发生明显右移。AR级和CR级柠檬醛对终年物 A值影响的比较,见 表1。
| 表1 不同纯度柠檬醛对终产物 A值影响的比较 |
本研究得出检测体系反应30 min趋于完全,产物在510 nm波长下有最大吸收,最优pH值为5.8,最优NaCl浓度为0.3 mol/L。在上述组合中,最优pH值的存在可能是偏酸有利于POD所催化的底物向中间产物醌的转化,进而使最终产物醌亚胺增多;最佳钠离子浓度的需求可能是由POD催化生成的终产物红色醌亚胺,是由醌与4-氨基安替比林发生分子间脱水反应生成的,过高或过低钠离子浓度环境都不利于醌的生成。
本研究首次发现柠檬醛对葡萄糖检测反应体系中GOD和/或POD具有的活性调节作用并且存在最适浓度。在一定浓度范围内柠檬醛能提高葡萄糖氧化终产物的生成量,并且二者函数关系曲线呈钟罩形,即存在一个最适柠檬醛浓度,其所对应的 A值为最大值。高于或低于这个浓度范围,柠檬醛均具有降低终产物生成量的作用。而相同浓度柠檬醛由于纯度的差异,使得其表观浓度与其实际浓度存在差异,纯度越高差异越小,所以相同表观浓度的柠檬醛,CR级样本的实际浓度要比AR级样本低。因此,理论上对应最大 A值的柠檬醛浓度应该也是CR级样本比AR级样本要高,即存在最适柠檬醛浓度发生向高浓度“漂移”的现象。因此,AR级与CR级柠檬醛的实验结果起到相互佐证的作用。
柠檬醛为α,β-不饱和醛,既具有还原性又有迈克尔反应受体活性[ 7]。其醛基作为氢供体与色原性氢供体TBHBA竞争与H2O2的反应,即具有减小表观 A值作用;其α,β不饱和双键作为亲电子体与酶蛋白中半胱氨酸(Cys)残基的-SH和赖氨酸(Lys)残基的ε-NH2进行共价结合[ 8, 9],即具有改变酶活性中心构象作用,使得底物更易/难与酶结合、中间复合物更易/难形成或使得产物更易/难生成。因此,理论上应该有使表观 A值增加或减少效应。由于前者是柠檬醛引起底物竞争性结合,而后者是引起酶活性改变,所以后者引起 A值变化幅度远大于前者。据此并结合本研究结果推测最适柠檬醛浓度存在的可能机制:当柠檬醛浓度较低时,通过扩散进入酶分子内部“酶活性中心”的几率很小,主要表现为竞争与H2O2反应而使表观 A值低于对照组。在71~426 μg/mL范围内各实验组的表观 A值均比对照组要低,其中最大减少量为对照组的20%;随着浓度增大,进入“酶活性中心”的柠檬醛也增加并与Cys残基、Lys残基发生共价结合,使酶活性中心构象更有利于催化反应进行。即使酶活性提高,尽管也存在柠檬醛的竞争性消耗H2O2,但前者的作用占主导地位,故呈现为表观 A值比对照组增加;伴随浓度继续增加,使更多酶被激活, A值也呈正相关增加;当所有酶都被柠檬醛结合并激活时 A值达到最大,即此时的柠檬醛浓度(1 220 μg/mL)为最适浓度。若继续提高柠檬醛浓度,由于酶的饱和性,柠檬醛与H2O2反应就会越来越多,引起 A值减小,综合表现为与最大 A值间的下降幅度越来越大,在2 480 μg/mL柠檬醛实验组的 A值下降到比对照组还要低50%左右。
虽然有文献报道[ 10]POD活性中心基团邻近均有Cys和Lys残基,但柠檬醛是提高了POD活性还是GOD活性或是二者兼有,目前还在研究中。此外,再对没有添加柠檬醛的反应体系进行反应时间与 A值相关性研究中,本研究发现酶促反应进行30 min已经达到动态平衡即产物量达到最大值,不再随作用时间增加而增多;但在最适柠檬醛浓度下,作用30 min后 A值几乎较对照组提高了1.2倍,这说明柠檬醛与酶作用后提高了酶活性,降低了反应活化能,使活化底物分子增多,生成更多的产物,故 A值提高。
基于唾液为样本的无创检测技术目前基本都是针对糖尿病患者。而随着生活习惯的改变,面临糖尿病隐患[ 11]的人群比例将会增加。因此,健康人进行日常性血糖监测重要性和必要性就不言而喻。本研究测定浓度范围的下限值为0.006 mmol/L,是健康人清晨空腹时的唾液葡萄糖平均浓度(0.05±0.01)mmol/L的1/10,所以本检测系统的灵敏度足以达到检测健康人的唾液葡萄糖浓度的要求。
此外,本研究还发现柠檬醛对维生素C也有一定的抗性,提示柠檬醛还具有替代抗维生素 C氧化酶的作用,这对相关产品生产的低成本化具有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|