通讯作者:潘柏申,联系电话:021-64041990-2376。
作者简介:赵瀛,女,1980年生,学士,主管技师,主要从事临床免疫工作。
评价3种抗环瓜丝氨酸(CCP)抗体检测试剂盒的分析性能,并比较临床应用。
方法收集93例类风湿性关节炎(RA)患者、118例非RA疾病(自身免疫性疾病82例、骨关节炎36例)患者以及20名表面健康人群的血清样本,评价罗氏、欧蒙、富纯3种抗CCP抗体试剂的分析性能,比较不同试剂间的相关性,评估各自的初步临床应用价值。
结果3种试剂检测精密度差异无统计学意义,批内、天间变异系数(
总体来说,不同方法抗CCP抗体检测试剂的检测结果之间具有一定的可比性,临床应用的诊断特性差异不明显,但标准化仍存在问题。
To evaluate the analytical performance of 3 assays for the measurement of anti-cyclic citrullinated peptide(CCP)antibodies, and compare the clinical application.
MethodsSerum samples from 93 patients with rheumatoid arthritis(RA),118 non-RA patients (82 patients with autoimmune diseases and 36 patients with osteo arthritis) and 20 healthy subjects were collected. The analytical performance of 3 reagents from Elecsys,Euroimmun and Fuchun was compared. The correlation was compared among the different reagents. The preliminary clinical application value for different reagents was evaluated.
ResultsNo statistical significance was found in precision of the 3 reagents.The within-run and interday coefficients of variation(
Overall, the analytical performance of anti-CCP assays is comparable among the different assays,and their diagnostic characteristics are not significantly different.However, the standardization still has problems.
类风湿性关节炎(RA)是一种慢性、炎症性致畸性疾病,全球近0.5 %~1.0 %的人群患有此病,其中75%是女性患者,发病2年即可出现不可逆的骨关节破坏。因此,RA的早期诊断和及时治疗是防止关节受到进一步损害的关键。但长期以来一直缺乏一个对RA的早期诊断敏感而特异的指标。现行的1987年美国风湿病协会(ACR)诊断标准[ 1, 2]主要依靠临床表现、X-线以及类风湿因子(RF)的检测,而符合此标准时患者常已出现骨关节破坏。同时由于RF特异性较差,在许多其他自身免疫性疾病、慢性感染或老年的健康人中都会出现[ 3, 4, 5]。所以,临床期待找到一个更灵敏且特异性更好的预示指标。
大量的研究发现早期RA患者的血清和滑膜液中存在抗环瓜丝氨酸(CCP)抗体,而且阳性患者出现严重关节损伤的概率明显高于阴性患者[ 6]。所以抗CCP抗体已被作为RA早期诊断及预后判断的重要标志物。
随着包被抗原和检测技术的不断提高,许多厂家上市推出了不同的抗CCP抗体检测试剂,同一检测项目同一样本采用不同的检测试剂可能会存在检测差异,而且由于抗CCP抗体检测缺乏国际参考物质,目前尚未标准化。因此,这些检测试剂本身的分析性能,以及临床实际应用情况成为了我们关注的焦点。
我们选用了罗氏、欧蒙和富纯的3种抗CCP抗体检测试剂,分别进行了分析性能的验证和初步临床应用的评估。
所有对象早晨8~9时空腹采集静脉血5 mL,1 h内分离血清,-80 ℃保存至检测。
1. RA组 2010年7至11月复旦大学附属中山医院风湿科门诊就诊的RA患者93例,其中男18例,女75例,年龄18~86岁。诊断标准采用ACR的RA诊断标准[ 2]。
2. 非RA疾病对照组 (1)各种自身免疫性疾病患者82例,包括系统性红斑狼疮28例、狼疮性肾炎18例、ANCA相关性血管炎3例、干躁综合症7例、结缔组织病7例、甲亢GRAVES病5例、溶血性贫血1例、韦格纳肉芽肿1例、硬皮病2例、重症肌无力2例、自身免疫性肝炎8例,其中男23例、女59例,年龄18~86岁;(2)骨关节炎患者36例,其中男12例、女24例,年龄26~83岁。
3. 健康对照组 随机选取复旦大学附属中山医院体检的表面健康人群20名,其中男10名、女10名,年龄25~73岁。
1. 试剂 (1)瑞士罗氏公司(简称罗氏)抗CCP抗体检测试剂(SFDA注册编号:国食药监械(进)字2009第2402350号,批号165183)及配套校准品和质控品,检测原理为电化学发光法,Cut-off值为17 RU/mL;(2)德国欧蒙公司(简称欧蒙)抗CCP抗体检测试剂(SFDA注册编号:国食药监械(进)字2008第2402505号,批号E110729AK)及配套校准品和质控品,检测原理为酶联免疫吸附法,Cut-off值为5 RU/mL;(3)上海富纯科新生物公司(简称富纯)抗CCP抗体检测试剂(SFDA注册编号:国食药监械(进)字2010第2400051号,批号EC110801)及配套校准品和质控品,检测原理为酶联免疫吸附法,Cut-off值为25 RU/mL。测试时各试剂盒均在有效期内。
2. 仪器 Modular E170全自动电化学发光免疫分析仪(罗氏公司);ST-360全自动酶标读数仪(上海科华生物技术有限公司);BK-W96A全自动洗板机(北京众合百克科学仪器技术有限公司)。
1. 精密度比较 用3种试剂分别测定高、低2个浓度的样本,每份样本重复测定20次,计算各自批内的均数(
2. 线性比较 CCP高值混合血清与阴性混合血清按9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9 比例稀释,充分混匀后进行复管检测,所有结果取均值后进行多项式回归统计和线性评估[ 7]。
3. 方法学比较 分别用3种试剂检测CCP抗体,比较两两之间的相关性。
4. 临床应用评估 分别用3种试剂检测RA组、非RA疾病对照组和健康对照组的CCP抗体水平,对检测结果进行ROC曲线分析,并评价临床RA的诊断特性。
采用SPSS 16.0统计软件计算
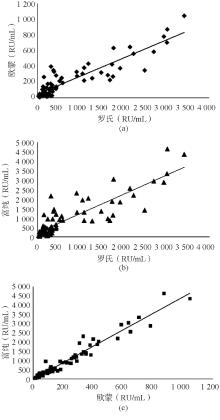
剔除超限值后得到的3种试剂的预期值与实测值散点图见 图1。3种试剂的检测线性范围的多项式回归分析结果见 表2。罗氏和欧蒙2种试剂检测线性范围基本覆盖了厂商推荐的检测范围,而富纯真实的线性范围明显低于厂商推荐的检测范围。
 | 图1 3种试剂线性评价注:(a)罗氏试剂, Y=0.990 X-2.781, R2=0.999, P=0.000;(b)欧蒙试剂, Y=1.01 X-4.00, R2=0.988, P=0.000;(c)富纯试剂, Y=1.1536 X-30.178, R2=0.966, P=0.000 |
| 表2 3种试剂的检测线性范围多项式回归分析 |
3种抗CCP抗体检测试剂的相关性比较见 图2。
抗CCP抗体作为RA的一个非常敏感且特异的指标,疾病的早期阶段即可出现阳性,并且具有很高的阳性预期值。为了解目前常用抗CCP抗体检测试剂应用情况,我们对罗氏、欧蒙、富纯3种试剂的分析性能和临床应用进行了评估。
在3种抗CCP抗体检测试剂的精密度实验中,低浓度和高浓度样本的批内、天间 CV均<10%,符合定量试剂要求,均满足临床应用需要,其中罗氏的电化学发光法试剂盒属于全自动免疫分析方法,其批内和天间 CV最好,均<3%。
在试剂检测范围的评估实验中,根据EP06-A的方法评价了3种试剂的线性情况,通过多项式回归方程分析发现3种试剂最适多项式均为一次多项式,可直接判断为线性,进一步进行稀释后得到真实的线性范围,罗氏和欧蒙基本覆盖了厂商推荐的检测范围,而富纯真实的线性范围明显低于厂商的声明目标。
本研究对3种抗CCP抗体检测试剂的检测结果之间的相关性进行了比较。3种试剂之间相关系数( r)均>0.85,3种试剂之间相关性较好。特别值得一提的是欧蒙和富纯2种试剂的检测原理都是酶联免疫吸附法,所以两者的 r高达0.97。由于这3种试剂均采用第二代重组环化的瓜氨酸肽类作为其抗原,所以避免了由于不同抗原所引起的差异,这与Coenen等[ 8] 的研究结果一致,同时文献报道相较第1代试剂而言,第2代试剂在不影响特异性的情况下提高了诊断灵敏度。但目前抗CCP抗体的检测方法由于缺乏国际参考物质[ 9],每个厂家采用其自身校准品进行校准,抗CCP抗体校准品及瓜氨酸表位中的差异已经被证实为不同方法之间可比性较差的根本原因。检测方法间的一致性只有通过采用同种抗原才能实现。因此,在抗CCP抗体检测标准化目标未达到之前,抗CCP抗体检测方法间不可避免存在差异,这种现状会给临床应用尤其是不同医疗部门之间的结果比对和资料分析带来困扰。
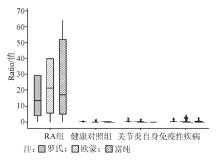
本研究结果证实RA组抗CCP抗体浓度明显高于健康对照组、非RA疾病对照组。富纯和欧蒙抗CCP抗体的ratio值高于罗氏。实验表明抗CCP抗体的检测对于RA患者具有很高的诊断价值,且能帮助临床医生鉴别诊断易与RA混淆的关节炎疾病。
在非RA的自身免疫性疾病中,28例SLE的患者中出现2例抗CCP抗体阳性(7.1 %),18例狼疮性肾炎的患者中有2例抗CCP抗体阳性(11.1 %),7例干燥综合征的患者中有1例抗CCP抗体阳性(14.2 %)。已有报道显示部分非RA的自身免疫性疾病患者会出现抗CCP抗体阳性。Mediwake 等随访了231位SLE患者,发现SLE在疾病早期阶段可能出现与RA同样的关节损伤和畸形,侵袭性的SLE患者抗CCP抗体阳性达到20 %,而非侵袭性的SLE患者抗CCP抗体阳性率仅为0.5 %[ 10]。所以,虽然抗CCP抗体对于RA患者具有较高的特异性,但在一些自身免疫性疾病中也可能出现阳性。此时建议结合临床表现,且与RF联合检测,以便提高RA与其他疾病之间的鉴别诊断能力。
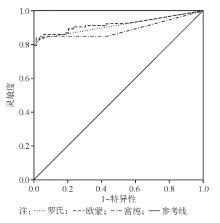
在初步临床应用分析中,本研究对231位受试对象的抗CCP抗体检测结果进行ROC曲线分析,结果显示3种检测试剂的AUC基本相同,诊断特性差异不明显。ROC分析显示3种试剂诊断性能均较好,灵敏度相似,特异性罗氏最高。为了解3种试剂的确诊值及排除值,本研究计算了3种试剂在诊断中的似然比,即在有病者中得出某一筛检实验结果的概率与无病者得出这一概率的比值,这能较全面客观地反映筛检实验的诊断价值。阳性似然比>10和阴性似然比<0.1分别是确定及排除实验令人信服的证据,3种试剂阳性似然比均>10,所以对RA疾病具有明确诊断价值;然而由于抗CCP抗体在一些自身免疫性疾病中也可能出现阳性,所以其阴性似然比并未完全达到疾病排除的要求。采用ROC最适的Cut-off值,欧蒙和富纯在不降低灵敏度的前提下,检测特异性及阳性似然比均得以明显提高,所以对于欧蒙和富纯2种检测试剂建议采用最适Cut-off值替代厂商推荐Cut-off值。
由于RA患者在首次就医时通常并不完全符合RA的临床诊断和分类标准,所以早期发现能帮助临床医生更好地进行诊断治疗。而现今的治疗手段仅着力于抗炎治疗并不能达到治愈的目的,因此在发生关节损伤之前更需要早期诊断。Rantapää-Dahlquist等[ 11]和Nielen等[ 12]证实了抗CCP抗体能鉴别那些无症状但随后会发展成为RA的隐匿型患者,抗CCP抗体阳性比RA症状的出现早4.5个月9年。所以,抗CCP抗体在早期诊断方面发挥着重要的作用。本研究由于资源有限,未能将患者进行早期RA(出现首次症状之前<1年)和已确诊RA(RA诊断>2年)的分类讨论。所以在RA早期诊断方面,以上3种抗CCP抗体检测试剂之间是否存在差异还尚待更进一步的研究阐明。
总的来说,3种抗CCP抗体检测试剂的分析性能均满足临床应用需要,罗氏检测系统的精密度略好,同时3种试剂对于RA的诊断价值也是相似的,所以抗CCP抗体不同试剂之间具有一定可比性。但试剂的标准化问题使得不同的抗CCP抗体检测试剂的结果间不可避免存在差异,所以标准化仍是现今刻不容缓需要解决的难题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|