作者简介:施德仕,男,1982年生,硕士,技师,主要从事细菌耐药机制研究。
通讯作者:邵海枫,联系电话:025-80860176
目的 分析从外科重症监护病房(SICU)分离的对碳青霉烯类药物耐药的3株摩根摩根菌(M1、M2和M3)的耐药机制和传播方式。方法 采用琼脂稀释法进行药物敏感性试验;肠杆菌科基因间重复性一致序列(ERIC)-聚合酶链反应(PCR)用于分析菌株的分子流行病学特征;特异性PCR 扩增检测细菌编码β-内酰胺酶的基因;接合试验和提取质粒进行酶切分析耐药基因可传递性和耐药质粒的同源性;耐药基因两边序列测序分析耐药基因的遗传背景;提取外膜蛋白电泳分析菌株外膜蛋白的改变。结果 3株分离菌和对应的接合子均扩增出介导碳青霉烯类耐药的肺炎克雷伯菌碳青霉烯酶( KPC)-2型基因,其中M1和M2为相同克隆株;质粒接合试验成功传递了对碳青霉烯类药物的耐药性, KPC-2基因被携带在酶切后片段完全不同的3个质粒上,耐药基因的遗传背景却相同;3株菌均缺失了相对分子质量约为38 000的外膜蛋白而出现36 000的外膜蛋白。结论 3株菌来自2种克隆株,均携带 KPC-2基因。该基因由3个不同的质粒携带,同一可移动序列可能介导了 KPC-2基因在3株细菌的不同质粒上转移。产KPC-2型碳青霉烯酶及外膜蛋白缺失可能共同导致了所分离的摩根摩根菌对碳青霉烯类抗菌药物耐药。
Objective To investigate resistance mechanisms to carbapenems and transmission modes of 3 Morganella morganii isolates (M1, M2 and M3) isolated from patients in surgical intensive care unit (SICU).Methods The susceptibility of antimicrobial agents was detected by agar dilution method. The molecular epidemiological characteristics of the isolates were analyzed by enterobacterial repetitive intergenic consensus (ERIC)-polymerase chain reaction (PCR). The encoding genes of beta-lactamases were analyzed by specific PCR amplification. The transitivity and homology of plasmids were detected by plasmid conjugation and restriction endonuclease analysis. Genetic environments around blaKPC were analyzed by sequencing. The changes of outer membrane permeability were analyzed by the electrophoresis of outer membrane protein.Results The blaKPC-2 was detected by PCR in all 3 isolates and their transconjugants. M1 and M2 were the same clonal type. Carbapenem-resistance was successfully transfered by conjugation experiments. The blaKPC-2 was located on dissimilar plasmids with quite different restriction profiles. The genetic environments around blaKPC-2 were the same. The 3 original Morganella morganii isolates showed a loss of 38 000 outer membrane proteins, and additional 36 000 outer membrane proteins appeared compared with the Morganella morganii isolates susceptible to carbapenems.Conclusions The blaKPC-2 is detected in the 3 Morganella morganii isolates belonging to 2 clonal types . This gene encoded by dissimilar plasmids is likely located on the same mobile genetic elements by which blaKPC-2 is possibly transferred between different plasmids. The KPC-2-producing and lack of outer membrane proteins together cause these 3 Morganella morganii isolates resistant to carbapenems possibly.
摩根摩根菌是肠杆菌科摩根菌属的惟一菌种, 是引起严重感染的条件致病菌, 常引起尿路和术后伤口的医院感染, 还能引起败血症、肺炎、肌炎、脑炎、心包炎、绒毛膜羊膜炎、眼内炎、特发性细菌性腹膜炎等炎症。肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemases, KPC)是最为常见的A类碳青霉烯酶, 最早从肺炎克雷伯菌检出, 随即在肠杆菌科细菌多个种属, 包括大肠埃希菌、阴沟肠杆菌、产气肠杆菌、产酸克雷伯菌、黏质沙雷菌、肠杆菌属、弗氏柠檬酸杆菌属、沙门菌属、拉乌尔菌属、奇异变形杆菌、霍氏肠杆菌, 均有检出KPC的报道[1, 2, 3]。本研究对从南京军区南京总医院外科重症监护病房(SICU)分离的3株产KPC-2型酶的摩根摩根菌的耐药机制和耐药基因传递方式进行分析与研究。
1.菌株来源 2008年4月至2010年1月从南京军区南京总医院SICU不同患者分离的3株碳青霉烯类抗菌药物耐药或敏感性降低的摩根摩根菌, 分离部位分别为血液(M1)、引流液(M2)和痰液(M3), 菌株经Vitek2 compact全自动微生物分析仪进行鉴定和药物敏感性试验。对照菌株为大肠埃希菌(ATCC 25922), 接合试验受体菌为大肠埃希菌(EC600), 质粒大小标准株为大肠埃希菌(V517)(由浙江大学附属一院俞云松教授惠赠)。
2.试剂与仪器 Vitek细菌鉴定仪(法国bioMé rieux公司), 聚合酶链反应(PCR, 德国eppendorf 公司), 质粒提取试剂盒(德国Qiagen公司), 限制性内切酶EcoR Ⅰ 、Hind Ⅲ 、Pst Ⅰ 以及Taq DNA聚合酶、dNTPS为日本TaKaRa公司产品。
1.药物敏感性试验 按照美国临床实验室标准化协会(CLSI)推荐的方法, 用琼脂稀释法测定12种药物和头孢他啶-克拉维酸、亚胺培南-克拉维酸对细菌的最低抑菌浓度(MIC), 结果按CLSI 2010标准判读。
2.染色体DNA同源性分析 以加热煮沸法提取摩根摩根菌全菌DNA作为模板, 进行肠杆菌科基因间重复性一致序列(ERIC)-PCR扩增, 扩增条件:95 ℃预变性7 min后, 95 ℃ 30 s, 50 ℃ 1 min, 65 ℃ 8 min, 30个循环, 65 ℃延伸16 min, 所用引物参见文献[4], 采用琼脂糖凝胶电泳对产物进行基因组同源性分析。
3.耐药基因扩增和测序 煮沸法提取细菌DNA, PCR扩增常见碳青霉烯类耐药基因, 包括blaKPC、blaIMP、blaVIM、blaSME、blaOXA-48、blaIMI/blaNMC 和blaGES-1, 以及常见超广谱β -内酰胺酶基因, 包括blaTEM、blaSHV和blaCTX-M, PCR引物及扩增条件参照参考文献[4-14]。产物送上海美吉生物公司测序, 所得序列与GenBank数据库进行比对分析。
4.接合试验 利福平耐药的大肠埃希菌(EC600, LacZ- NalR RifR)作为受体菌。取过夜培养的供体菌200 μ L和受体菌200 μ L 于 1 mL水解酪蛋白胨(MH)肉汤35 ℃混合培养24 h。取1~2 μ L混合培养菌液接种含256 μ g/mL 利福平和1 μ g/mL 美罗培南的MH琼脂平板。挑取选择培养基上的单个菌落鉴定为大肠埃希菌后, 转种含上述2种药物的MH液体培养基培养24 h, 并再次转种含上述2种药物的MH琼脂平板。
5.质粒提取和质粒分析 用Qiagen plasmid midi kit提取质粒, 3株分离菌和对应的接合子所提取的质粒先经PCR扩增确认所携带的基因, 再用EcoRⅠ 、HindⅢ 和PstⅠ 3种限制性内切酶分别酶切质粒, 0.7%琼脂糖凝胶80 V 70 min电泳质粒酶切产物后, 用LabImage-1D 凝胶分析软件(2.7.1版, 德国Kapelan公司)分析。
6.初步blaKPC遗传背景分析 由质粒电泳图谱可知接合子质粒成分相对单一, 所以选择接合子质粒作为研究对象。根据KPC-2基因(登录号:AY034847)设计1对引物KPC-F1 (5'-CGCCTAACAAGGATGACAAG-3')和KPC-R1 (5'-ACTTACAGTTGCGCCTGAGC-3'), 对blaKPC两边的基因序列进行测序分析, 测序结果用DNAMAN 软件(6.0.3.99版, 美国LynnonBiosoft公司)与KPC-2基因拼合, 所得序列与GenBank数据库进行比对分析。见图1。
7.外膜蛋白分析 按照Hernandez-Alles等[15]报道的方法提取菌株外膜蛋白, 进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 考马斯亮蓝(美国Sigma公司)染色后, LabImage-1D 凝胶分析软件计算蛋白相对分子质量。
药物敏感性试验结果见表1。除美罗培南对M3的MIC值在敏感折点外, 3株菌对所检测的3种碳青霉烯类和头孢菌素类(包括单环类)药物均耐药, 对喹诺酮类、氨基糖苷类(除外阿米卡星)和阿奇霉素也耐药。加入克拉维酸后头孢他啶和亚胺培南的MIC值下降24个倍比稀释度。接合子碳青霉烯类、头孢菌素类、氨曲南MIC值明显高于受体菌大肠埃希菌(EC600)。
| 表1 3株摩根摩根菌及其接合子的药物敏感性表型 |
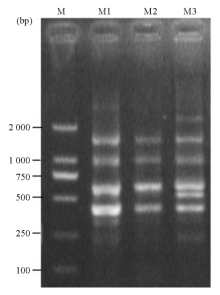
ERIC-PCR产物显示3株摩根摩根菌中M1和M2株属于同一克隆型, 而M3株属于另一克隆型, 见图2。
3株分离菌均扩增出KPC-2基因和TEM-1基因, M2和M3扩增出SHV-1a基因, M3扩增出CTX-M-3基因。3株分离菌的接合子均扩增出KPC-2基因, 而未扩增出超广谱β -内酰胺酶基因。
通过接合试验成功将3株分离菌对碳青霉烯类和其他β -内酰胺类药物的耐药性传递给受体菌。与供体菌相比, 接合子尽管对这些药物的MIC值均有2~4个倍比稀释度降低, 但大多在耐药和中介水平。对沙星类、氨基糖苷类药物和阿奇霉素的耐药性未被传递。
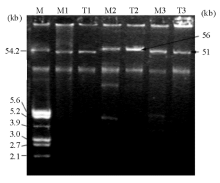
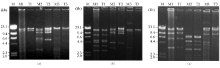
M1和M3株及其接合子均提取出51 kb的质粒, M2及其接合子的质粒为56 kb, 见图1。质粒DNA扩增测序证实KPC-2被携带在质粒上。限制性内切酶EcoR Ⅰ 、Hind Ⅲ 和Pst Ⅰ 的酶切结果显示, 3株菌所携带的质粒完全不同, 见图3。
引物KPC-F1和KPC-R1的测序结果与KPC-2基因(登录号:AY034847)拼合, 得到3个相同的为2.6 kb的有效序列, GenBank数据库上比对发现, 与Shen等[16]报道的blaKPC遗传背景(登录号:FJ628167.2)中18 646 bp21 245 bp序列完全相同。
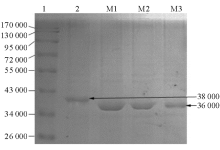
3株摩根摩根分离菌均缺失了相对分子质量约为38 000的外膜蛋白, 而出现了相对分子质量约为36 000的外膜蛋白, 见图4。对照所用敏感株的外膜蛋白大小与已报告的摩根摩根菌(NCTC-235)相同[17]。
讨 论
我们分离的产KPC-2型酶的摩根摩根菌表现对多种抗菌药物不同程度的耐药。药物敏感性表型显示, 除美罗培南对M3株的MIC值在敏感界值, 厄他培南和亚胺培南的MIC值均高于耐药折点。结合联合克拉维酸后头孢他啶和亚胺培南的MIC值下降24个倍比稀释度, 以及质粒传递后接合子MIC值降低≥ 3个倍比稀释度等诸多表型, 考虑在这3株菌中KPC-2酶、高活性头孢菌素酶和药物的渗透障碍共同造成了菌株对几乎所有β -内酰胺类药物的耐药性。再加上对氟喹诺酮类、大多数氨基糖苷类药物和阿奇霉素的耐药, 增加了临床抗感染治疗的难度。
通过接合试验, 3株菌成功的将对碳青霉烯类和其他β -内酰胺类药物的耐药性传递给受体菌, 未传递对其他类药物的耐药性, 因未做更多的工作, 我们推测该质粒只携带介导编码β -内酰胺类药物的基因或接合子不能表达对其他药物的耐药性。3株分离菌属于2个不同的克隆型, 质粒上均携带KPC-2基因。但菌株克隆型与所携带的质粒大小并不相关, M1和M2属同一克隆却分别携带51和56 kb大小不同的2种质粒, M3属于另一克隆型, 携带了51 kb的质粒。令我们更感兴趣的是无论用EcoR Ⅰ 、Hind Ⅲ 或Pst Ⅰ 限制性内切酶酶切后, 3个质粒均被切成完全不同的片段模式, 检测KPC-2基因两边序列, 结果都表现为3个质粒所携带的KPC-2基因遗传背景相同。已有的研究表明, KPC基因通常位于可移动的基因序列上, 尤其是转座子Tn4401及其相关的基因序列, 从而使KPC基因能够在不同质粒间传递[18, 19]。但我们分离的菌株KPC-2基因遗传背景并非国外常见的转座子Tn4401, 而与国内Shen等[16]报道的blaKPC遗传背景— — 复合转座子相同。结合上述分析, 我们认为尽管我们分离的这3株菌分属2个克隆型, KPC-2基因被携带在有较大差异的3个质粒上, 但仍可能通过相同可移动序列在不同的质粒上转移。这种转移方式增加了细菌获得耐药性的概率, 引起更严重的院内耐药性传递。
外膜蛋白缺失或数量的减少, 引起外膜通透性的改变是导致细菌耐药性发生的重要机制之一。已有报道称大小为37 00038 000外膜蛋白缺失或数量减少可引起摩根摩根菌对头孢菌素类、青霉素类和喹诺酮类药物敏感性降低[17, 20]。本研究中碳青霉烯类和头孢菌素类药物对3株分离菌的MIC值均高于接合子, 更高于敏感对照菌株。可以认为38 000的外膜蛋白的缺失增加了所分离的3株摩根摩根菌对碳青霉烯类药物的耐药值。
用单一的耐药模式已很难解释目前在医院中流行的各种耐药株的耐药机制, 往往需要做更细致和深入的研究才能揭示与耐药相关的本质, 用以预防和减少耐药性的传播。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|