作者简介:蒋玲丽,女,1980年生,硕士,主管技师,主要从事免疫学和分子生物学质量控制工作。
通讯作者:张健,联系电话:021-68316300。
目的 评估不同国际标准提供的允许总误差(TEa)下特定蛋白检测的分析性能差异,运用6西格玛(σ)参数选择和优化质量控制规则。方法 收集2009和2010年的室内质量控制数据以及参加卫生部临床检验中心的能力比对实验的数据,计算各检测项目的不精密度和偏倚(Bias)。TEa分别引用美国临床试验室修正法案(CLIA' 88)、德国Rilibak质控指南以及生物学变异的要求。根据变异系数( CV)、Bias和TEa计算σ值,同时绘制标准化σ性能评价图。计算未达6σ的质量目标指数(QGI),查找导致性能不佳的主要原因,以判断优先改进精密度或准确度。结果 2009年IgA、IgG、IgM、C3、C4、C反应蛋白(CRP)6个检测项目根据3种不同的TEa要求计算的σ水平从0.53~6.95不等,除生物学变异要求下的CRP σ值为6.95,其余均未达到6σ。2010年6个项目的σ水平从1.33~29.39不等,除IgG项目和生物学变异要求下的IgA和C3未达到6σ要求外,其余均达到了6σ要求。结论 根据σ水平可以评价实验室的分析性能并选择室内质量控制规则,经济合理的开展室内质量控制。
Objective To evaluate the performance of specific protein under different allowable total error (TEa) of different international standards, apply 6 sigma (σ) metrics into selecting and improving quality control rule.Methods The data from internal quality control and the proficiency test of the National Center for Clinical Laboratory in 2009 and 2010 were collected respectively, and the imprecision and bias were calculated. TEa was quoted from Clinical Laboratory Improvement Amendments 88 (CLIA' 88), German Guidelines for Quality and biological variation requirements. According to the coefficient of variation ( CV), bias and TEa, σ was calculated, and quality control strategy was designed. In addition, the quality goal index (QGI) below 6σ was calculated to find problem and decide the priority improvement of precision and accuracy.Results According to IgA, IgG, IgM, C3, C4 and C reactive protein (CRP) with 3 different TEa in 2009, the σ were 0.53-6.95 respectively. The items were below 6σ except CRP, and under biological variation requirements the CRP σ was 6.95. In 2010, the σ of the 6 items was 1.33-29.39 respectively, and all items were above 6σ except IgG and C3 under biological variation requirements.Conclusions Using the σ metric, the performance and appropriate internal quality control can be chosen and developed economically and reasonably.
根据检验项目的分析性能采用不同的质量控制规则开展室内质量控制工作, 是临床实验室经济高效的开展质量控制工作的发展方向。结合了允许总误差(total allowable analytical error, TEa)与分析性能[偏倚(Bias)和变异系数(CV)]的6西格玛(σ )质量管理技术, 是量化检验项目分析性能的方法之一[1]。建立和使用6σ 质量管理技术对于临床实验室而言, 首先是要引用合理的质量规范, 来量化实验室的检验项目的分析性能。目前, 多数的实验室采用美国临床实验室修正法案(CLIA' 88)的室间质评的总误差要求制定检验项目的TEa。但对于一般的免疫学检测项目, CLIA' 88提供的多是
西门子公司的Dade Behring BN ProSpec全自动血浆蛋白分析系统及其原装配套的试剂盒和校准品。质控品采用英国朗道公司的产品, 包括高、低2个水平的质控品, 批号为6961B、6861C和165LPC、166LPC。
1.评价项目 选择IgA、IgG、IgM、C3、C4、C反应蛋白(CRP)共6个临床使用最多的特定蛋白检测项目。
2.质控性能 确定TEa分别引用TEa-88、TEa-Rili和TEa-Bio计算的TEa要求等不同来源的国际标准中上述6项特定蛋白的总误差要求。CLIA' 88提供的IgA、IgM、C3、C4的TEa要求。以
3. 分析项目σ 水平计算 不精密度σ 值=TEa/CV; 总分析性能σ 值=(TEa-Bias)/CV。
4.计算质量目标指数(quality goal index, QGI)[2] QGI=Bias/(1.5× CV)。当QGI< 0.8, 提示导致方法性能不佳的主要原因是精密度超出允许范围, 优先改进精密度; 当QGI> 1.2, 提示方法准确度较差, 优先改进准确度; QGI在0.8~1.2之间, 提示准确度和精密度均需改进。
| 表1 不同国际标准的特定蛋白允许总误差要求 |
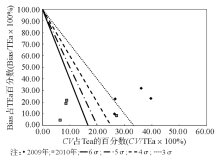
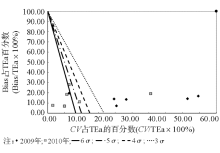
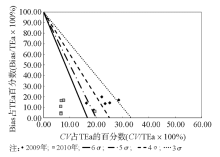
5.绘制标准化σ 指标方法性能评价图[3] 以TEa记为100%, 过点(0, 100)、(16.67, 0)作直线, 对应6σ 性能线; 过点(0, 100)、(20, 0)作直线, 对应5σ 性能线; 过点(0, 100)、(25, 0)作直线, 对应4σ 性能线; 过点(0, 100)、(33.33, 0)作直线, 对应3σ 性能线。4条σ 性能线把图划分成5个区域, 自左向右依次代表6σ 性能区、5σ ~6σ 性能区、4σ ~5σ 性能区、3σ ~4σ 性能区和< 3σ 性能区。然后标记每个项目的操作点:横坐标为CV占TEa的百分数, 纵坐标为Bias占TEa的百分数。
6.根据σ 性能选择质控规则 根据Westgard等[4]推荐的经验方法, 根据检测系统的不同σ 性能可以选择不同的质控规则, 对于6σ 水平以上的分析性能可选用, n=2、13s/13.5s质控规则; 5σ 选用n=2、12.5s/13s质控规则; 4σ 选用n=4、multirules/12.5s; 4σ 以下的性能选用尽可能多的质控品(n≥ 4)和严格的质控规则(13s /22s/R4s /10x)。
CV为2009和2010年的室内质控数据计算, 计算2个浓度的平均水平, Bias为本实验室2009和2010年参加卫生部临床检验中心2次结果的均值。结果见表2。
不同标准来源的总误差计算的σ 水平、候选的质控规则以及需要优先改进的指标。见表35。
| 表2 2009年和2010年各项目的CV和Bias |
| 表3 TEa-88计算的σ 水平、质控规则及优先改进的指标 |
| 表4 TEa-Rili计算的σ 水平、质控规则及优先改进的指标 |
| 表5 TEa-Bio计算的σ 水平、质控规则及优先改进的指标 |
'> | 图1 标准化σ 指标方法性能评价图(CLIA' 88) |
开展临床定量检验项目的室内质量控制需要选择具有较高误差检测概率和合理的假失控概率的质量控制规则, 同时应该考虑检测方法的分析性能与质控规则之间的关系。使用的Westgard多规则开展临床定量检验项目的室内质量控制已被多数的临床实验室所接受。6σ 管理法中提到的6σ 代表的是质量水平, 为了使检验结果具有预期的质量效果和极低的误差, 临床实验室也开始引入6σ 质量标准来评价室内质控的质量水平。并且随着6σ 质量管理技术被引入到临床实验室的质量管理工作中, 根据检验项目的6σ 质量水平来选择合理的质量控制规则, 可以经济高效的开展质量控制[5]。
对于临床实验室而言, 建立和使用6σ 质量管理技术首先是要引用合理的质量规范, 来量化实验室的检验项目的分析性能。目前, 多数的实验室检测项目采用CLIA' 88的室间质评的总误差要求制定TEa。但对于一般的免疫学检测项目, CLIA' 88提供的多是以
2009年, 不同TEa计算的本实验室特定蛋白的基于σ 水平的分析性能显示, 按照TEa-88要求, 即使按照上海地区当时的室间质评数据体现的分析总误差, 也只有2项在4σ 水平以上, 3项在3σ 水平以上, 1项为2.91。按照TEa-Rili和TEa- Bio要求, 只有CRP的分析性能在6σ 水平以上, 其余分析性能均在6σ 水平以下。具体的TEa-Rili要求, σ 值为1.893.42; TEa-Bio要求, 除CRP为6.95, IgM为2.08, 其余均< 2, 最小的只有0.53。6σ 代表国际质量水平[3], 说明每百万个产品/或服务的缺陷只有2个, 是期望达到的最终质量目标。分析2009年的数据, 从表2可以看出2009年实验室6个项目的CV最大达到了8.20%, 从4.48%8.20%不等。本研究通过计算QGI, 指出要提高特定蛋白的检测性能首先要改进实验的精密度。由于特定蛋白项目是当时新开展的项目, 在对实验进行分析后, 发现质控品存在储存不当的问题, 质控品在开瓶后如果不避光保存或在实验中放置在室温下时间过长都会引起实验数据向上漂移。通过分析后, 我们每次将质控品都分装在避光的瓶子中, 并且每次都是做完质控就将质控品放回冰箱保存。解决问题后, 2010年实验室特定蛋白6个项目的CV最大为6.77%, 从1.26%~6.77%不等, 其精密度从2009至2010年有了很大的改善。从表35和图13可以看出, 通过改进精密度, 2010年TEa-88要求下, 除IgG项目为4.80, TEa-Rili要求下, 除IgG项目为3.37, TEa-Bio要求下, 除IgG项目为1.33、C3为4.67、IgA为5.63外, 其余都为6σ 以上。可以看出, 标准化σ 评价图可以非常直观的显示实验数据。经过1年的改进, 各项目的检测性能都有了很大的提高。虽然, 在不同的TEa要求下, 还有项目未达到6σ , 但相比较2009年还是有了很大的提高。另外, 通常实验室特定蛋白项目采用的是13s这个质控规则, 但通过这2年的数据分析, 结合σ 性能分析和Westgard等推荐的经验方法选择质控规则, 13s这个单质控规则显然是不合适的。所以运用σ 理论评价检验阶段的性能, 选择合适的质控规则是一个很好的方法, 并通过QGI的计算指出首先改进的指标对检验阶段性能的评价和改进非常有益。
通过计算发现在不同的TEa要求下, 各项目计算的σ 值肯定不同, 所得分析性能结果也肯定不同, 实验室应该选择合理的TEa要求, 本研究认为上述6个项目如果根据CLIA' 88的TEa要求是否显得太松?但这需要实际工作中用数据进一步去论证并且结合实验室的实际情况进行选择。但总的来说, 运用σ 理论评价检验阶段的性能, 选择合适的质控规则, 可以节约大量的人力、物力和时间成本。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|