作者简介:彭凤,女,1978年生,学士,主管技师,主要从事临床生物化学检验工作。
通讯作者:于嘉屏,联系电话:021-5181647
免疫透射比浊测定技术(immunoturbidimetry)和免疫散射比浊测定技术(immunonephelometry)是目前检测人血清中特定蛋白的2种常用方法。目前以散射比浊为原理的特定蛋白分析仪已在医学检验领域普遍使用。人们传统地认为散射比浊法要比透射比浊法更灵敏, 准确度高, 包括许多教科书也是这样认为的。然而, 随着科技的发展, 免疫学技术以及全自动生化分析仪技术日趋完善, 透射比浊法已逐渐成熟, 现已发展成为绝不逊于散射比浊法的常用测定特定蛋白的方法。
近年来, 相继有不少文献对应用全自动生化分析仪的免疫透射比浊技术测定血清特定蛋白的方法学性能等方面进行了阐述, 并与免疫散射比浊技术进行比较[1, 2, 3, 4, 5, 6, 7, 8]。这些比较研究的结果表明, 免疫透射比浊法的精密度非常高, 大大高于散射比浊法; 且与散射比浊法的一致性很好; 抗干扰能力也较强; 无论是定标稳定性还是开瓶试剂稳定性均能维持较长时间; 检测速度快, 消耗成本较低; 结果的重复性及准确性已超越或不亚于免疫散射比浊法。
为什么传统认为检测性能不如散射比浊法的透射比浊技术现已逐渐在医学检验领域大量应用?这得益于免疫学技术、全自动生化分析仪的快速发展。我们从以下几个方面来阐述免疫透射比浊技术的性能。
长期以来, 人们普遍认为免疫透射比浊法的敏感性不够理想, 检测范围不够宽, 原因是免疫复合物颗粒太小, 阻挡不了光线的通过; 或是免疫复合物的数量太少, 其浊度变化对光通量的透过影响不大, 特别是在低浓度时更加明显。近年来, 发展起来的胶乳增强免疫透射比浊法(particle-enhanced turbidimetric assay, PETIA)大大缓解了这一难题[9, 10, 11]。该方法是将抗体连接在微小的胶乳颗粒(d> 1 000 nm)上, 当抗原抗体相结合时便形成了抗原-抗体-胶乳颗粒复合物, 大大增加了抗原抗体复合物颗粒的直径, 检测敏感性可以提高1 000倍以上, 同时其受到非特异性反应的影响也大大减少, 因而精确度和重复性皆较好。见图1。
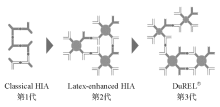
特别是双胶乳颗粒连接的双抗体技术(DuREL® 专利技术, dual radius latex-enhanced technology)最近也得以应用于免疫透射比浊法, 其中大胶乳颗粒包被了高反应性抗体, 以提高分析敏感性; 小胶乳颗粒包被了低反应性抗体, 以此来扩展测量范围, 使得检测敏感性及检测范围大大改善。以C反应蛋白(CRP)为例, 第1代试剂为传统的免疫透射比浊法, 其检测范围为3250 mg/L; 第2代试剂采用PETIA, 其检测范围为1.3250 mg/L; 而第3代试剂则为双胶乳颗粒连接的双抗体技术, 其检测范围为0.3350 mg/L, 分析敏感性与测量范围均大大增加。见图2。
表1列举了常用特定蛋白项目在罗氏生化分析仪(免疫透射比浊法)与西门子特定蛋白分析仪(免疫散射比浊法)上的检测范围, 通过比较可以得出结论:免疫透射比浊法的检测低限及范围
已不亚于免疫散射比浊法。
| 表1 常用特定蛋白项目的测量范围 |
免疫透射比浊的透射光分析与临床化学中的吸收光谱不同, 不符合Lambert-Beer光吸收定律(logI0/Ib=k· b· c)。在免疫比浊过程中, 抗原抗体结合量与透射光之间是不呈线性关系的, 一般是3次方程曲线关系。若将抗原与抗体2个变量之间的变动特征恰当地反映出来, 需要经过3次方程拟合成近似直线化的曲线方程, 再进行运算。免疫比浊中, 一般采用5个或7个不同梯度浓度的校准品进行定标, 经3次曲线方程求出一条能反映真实情况的浓度与光密度的关系曲线方程, 才能作为定量的工作曲线。
早先的生化分析仪的比色系统基于 Lambert-Beer定律, 校准曲线往往为直线, 不具备非线性拟合的能力。而现代的全自动生化分析仪功能相当完善, 其校准曲线拟合功能也非常齐全, 往往具备多种数学函数方程供非线性拟合之用。如线性函数(linear functions)、多项式函数(polynomial functions)、指数函数(exponential functions)、对数函数(logarithmical functions)、样条函数(spline functions)、多参数的对数值对数函数(logit-log functions)等。测定结果的准确与否在很大程度上取决于适当的曲线拟合[12, 13]。采用一种合适的曲线拟合, 能大大改善检验结果的准确性。
由于免疫方法检测的特殊性, 当样本中的抗原量过剩时容易出现可溶性复合物, 会造成测定误差。因此抗原过剩的监测是检测结果质量控制的另一个重要保证。其实抗原过剩的识别问题是免疫透射比浊法与免疫散射比浊法共同面临的一个问题[14, 15]。
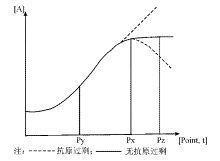
全自动生化分析仪上的线性检测功能可发现特殊样本的抗原过剩问题, 通过设置合适的仪器参数即可对这些样本进行监测, 对可疑抗原过剩的样本可自动减少样本容量或自动稀释样本后再重新检测。通过定时监测吸光度、观察时间反应进程曲线, 就可清楚地判断是否出现抗原过剩, 见图3。往往可以在生化分析仪上设置限定参数, 如线性限值, 用于检查反应是否在平衡期(或线性期); 试剂吸光度限值, 用于检查试剂是否浑浊变质。
罗氏公司生产的特定蛋白试剂所采用的校准品中, CRP可溯源至ERM-DA472[16, 17], 其他13种特定蛋白校准品值可溯源至ERM-DA470k[18, 19]。而ERM-DA472和ERM-DA470k的前身即为CRM 470。目前已对13种血清蛋白质定值, 包括前白蛋白、白蛋白、α 1酸性糖蛋白、α 1抗胰蛋白酶、结合珠蛋白、α 2-巨球蛋白、转铁蛋白、补体3、补体4、免疫球蛋白A、免疫球蛋白G、免疫球蛋白M和CRP。
1989年国际临床化学学会(IFCC)会同美国病理学会(CAP), 在与各重要厂商(Abbott、Beckman、Dade-Behring等)协商后, 指定由Dade-Behring公司负责制备国际参考品。按照IFCC定值方案, 统一使用指定的各特定蛋白纯化标准为原始标准, 避免各实验室因使用的标准不一致造成定值差异, 方案详细规定了定值的操作程序以及统计方法。例如, 为确保在检测时各标准、样本间无基体效应的差异和没有抗原过剩, 要求回归线通过零点, 标准和测定都须做多个稀释(须以重量法校正), 每个稀释样本做双份检测等。这使27个定值实验室(欧洲、美国和日本)步调一致, 在规定期限内完成定值。允许的测定方法为:免疫透射比浊法、免疫散射比浊法和放射免疫扩散法。1993年欧洲共同体标准物质局(BCR)认可该参考品, 并给予代号CRM 470(认可参考品470)。
使用CRM 470标准后, 各重要厂商(Abbott、Beckman、Dade-Behring等)都已签署认可CRM 470作为他们公司的第一标准, 这带来了一系列的良好效果:如实验室结果的可比性得以改善; 依赖方法偏差很低; 成年人的参考范围的一致性; 液体和尿液的分析也可以得到改善。近年来, 其他非签署公司要对自己的校准品定值时, 都已采用上述公司的特定蛋白检测系列, 按照数值传递试验方案, 对本公司校准品定值。然后再以患者样本和认可的上述公司检测系列作方法学比较, 确认传递的可靠性, 再将产品系列推向市场。这些进展使特定蛋白的检测更加可靠, 促进了国际血清蛋白检测的标准化。
在对ERM-DA472及ERM-DA470k (CRM 470)的定值过程中, 透射比浊法与散射比浊法都为之做出了贡献, 其校准值同样可用于2种方法。也就是说, 免疫透射比浊法检测血浆特定蛋白的校准品可以溯源至国际标准。
免疫透射比浊法与免疫散射比浊法相比, 还有其他优势。
1.抗干扰能力强 免疫复合物、免疫球蛋白聚集、脂蛋白以及胆红素或游离血红蛋白等都可对光散射或光透射分析结果产生干扰。而免疫透射比浊法所采用的全自动生化分析仪可联合应用双波长检测, 样本自动稀释, 与样本空白对照检测, 有助于最小化这些因素对检测的影响。因此, 免疫透射比浊法的抗干扰能力较强[20, 21]。
2.仪器投资成本较低 免疫透射比浊分析是在全自动生化分析仪上进行的, 因此不需要另行配备专用的特定蛋白仪。
3.试剂消耗成本较低 免疫透射比浊法的试剂相对成本较低, 且试剂开启后稳定, 校准周期较长, 故总体消耗成本较低。
4.有利于患者 由于采样可与生化样本合并, 故可降低采血管成本, 也有利于患者。
5.检验结果回报时间短 生化分析仪的检测速度要远远快于使用免疫散射比浊法的特定蛋白仪, 使得检验报告时间大大提前, 降低周转时间。
6.易于规范管理 由于生化、免疫学采用的都是血清样本, 合并到生化分析仪上后易于对科室进行质量管理以及行政管理。为进一步理顺工作流程打下基础。
综上所述, 与免疫散射比浊法比较, 免疫透射比浊法具有更优的精密度、相似的分析敏感性和检测范围、良好的相关性、较小的系统误差、较强的抗干扰能力, 且更加实用和便利, 是一项值得推广应用的技术。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|