通讯作者:应春妹,联系电话:021-58752345-3299。
作者简介:侯盼飞,男,1984年生,硕士,主要从事细菌耐药机制研究。
研究亚胺培南耐药鲍曼不动杆菌(IRAB)耐药性与主动外排泵之间的关系,从而指导临床合理用药及控制院内感染。
方法收集临床分离的IRAB 50株,亚胺培南敏感鲍曼不动杆菌(ISAB)30株。采用琼脂稀释法检测上述细菌对13种抗菌药物的最低抑菌浓度(MIC),加入外排泵抑制剂Phe-Arg-beta-Naphthylamide (PAβN)观察对亚胺培南MIC变化;脉冲场凝胶电泳(PFGE)分析菌株同源性;聚合酶链反应(PCR)检测 adeB、 adeR、 adeS、 adeJ、 abeM基因。
结果50株IRAB中MIC50>128 μg/mL的抗菌药物有阿米卡星、环丙沙星、哌拉西林-他唑巴坦、头孢哌酮、头孢西丁、四环素和复方磺胺甲口恶唑,MIC50在32128 μg/mL的抗菌药物有美罗培南、头孢哌酮-舒巴坦、头孢吡肟、头孢他啶、头孢曲松、头孢噻肟,MIC50<8 μg/mL的抗菌药物有左氧氟沙星和多黏菌素B。对30株ISAB,MIC50<8 μg/mL的药物有美罗培南、阿米卡星、头孢哌酮-舒巴坦、头孢他啶、头孢吡肟、多黏菌素B。加入抑制剂,33株IRAB(66%)对亚胺培南的MIC有432倍的降低,ISAB无明显变化。根据PFGE图谱可分为7型,A型为主要流行株。PCR扩增,IRAB的 adeB、 adeR、 adeS、 adeJ、 abeM基因检出率均>80%,与ISAB相比,差异有统计学意义( P<0.01)。
结论仁济医院IRAB存在播散流行,且有AdeABC、AdeIJK、AbeM等外排泵广泛存在。
To study the relationship between resistance and active efflux pump in imipenem-resistant Acinetobacter baumannii (IRAB), and guide the rational use of antibiotics and the control of nosocomial infections.
MethodsA total of 50 IRAB and 30 imipenem-sensitive Acinetobacter baumannii(ISAB) were collected from clinical specimens. The minimum inhibitory concentrations (MIC) to 13 antibiotics were determined by agar dilution method, and the changes of MIC in imipenem by adding Phe-Arg-beta-Naphthylamide(PAβN, a kind of pump inhibitor) were observed. Homology was analyzed by pulse-field gel electrophoresis (PFGE). The adeB, adeR, adeS, adeJ and abeM genes were amplified by polymerase chain reaction (PCR).
ResultsIn 50 IRAB, the antibiotics of MIC50>128 μg/mL included amikacin, ciprofloxacin, piperacillin-tazobactam, cefoperazone, cefoxitin, tetracycline and sulfamethoxazole. The antibiotics of MIC50 from 32 to 128 μg/mL included meropenem, cefoperazone-sulbactam, cefepime, ceftazidime, ceftriaxone and cefotaxime. The antibiotics of MIC50<8 μg/mL included levofloxacin and polymyxin B. In 30 ISAB, the antibiotics of MIC50<8 μg/mL included meropenem, amikacin, ceftazidime, cefepime, cefoperazone-sulbactam and polymyxin B. The MIC of 33(66%) IRAB in imipenem decreased 4 to 32 times after adding PAβN, while ISAB had no obvious changes. According to PFGE,80 isolates could be classified into 7 types, and type A was the major clone. By PCR amplification, the detection rates of adeB, adeR, adeS, adeJ and abeM genes were >80% in IRAB. There were significant differences in all genes compared with those of ISAB( P<0.01).
ConclusionsThere is an endemic of IRAB in Renji Hospital, and AdeABC, AdeIJK and AbeM efflux pump widely exist.
鲍曼不动杆菌是一种革兰阴性球杆菌, 该菌广泛分布于医院环境中, 是一种重要的机会病原菌, 能引起一系列院内感染, 如菌血症、尿路感染、继发性脑膜炎、手术部位感染及呼吸机相关性肺炎等, 严重威胁患者生命。近年来, 临床检出率、耐药率呈逐渐上升的趋势, 尤其是碳青霉烯类耐药株的出现, 给临床治疗带来很大挑战。本研究分析了仁济医院80株鲍曼不动杆菌对常用抗菌药物的耐药性, 采用脉冲场凝胶电泳(PEGE)分析同源性, 并对外排泵与亚胺培南耐药的关系进行初步研究。
1. 临床菌株 收集2009年1月至10月仁济医院分离的鲍曼不动杆菌共80株, 其中亚胺培南耐药鲍曼不动杆菌(IRAB)50株, 亚胺培南敏感鲍曼不动杆菌(ISAB)30株, 标本种类包括痰液、尿液、血液、脑脊液、脓液、胸水、腹水、咽拭子、胆汁、插管等。所有菌株经VITEK-32细菌鉴定仪鉴定。
2. 质控菌株 大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)。
3. 抗菌药物 阿米卡星、环丙沙星、左氧氟沙星、头孢他啶、头孢西丁、头孢哌酮、他唑巴坦、舒巴坦、磺胺甲口恶唑、甲氧苄啶、美罗培南、多黏菌素B等抗菌药物制剂购自上海科佳药检器材公司。哌拉西林、头孢噻肟、头孢曲松、四环素由华山医院抗生素研究所惠赠, 头孢吡肟由中美上海施贵宝制药有限公司惠赠, 亚胺培南由默沙东制药有限公司惠赠。
4. 试剂 Taq DNA 聚合酶、10× 聚合酶链反应(PCR)缓冲液(含MgCl2)、dNTPs mixture为上海闪晶分子生物科技有限公司产品。
5. 仪器 VITEK-32细菌鉴定仪为法国生物梅里埃公司产品, CHEF-MapperXA型脉冲电泳仪为美国BioRad公司产品, PCR扩增仪为美国ABI公司产品, 凝胶成像仪为上海天能科技有限公司产品。
1. 药物敏感性试验 用琼脂稀释法检测80株鲍曼不动杆菌对抗菌药物的最低抑菌浓度(MIC)。试验方法及结果判断标准参照美国临床实验室标准化协会(CLSI) 2009年版标准。(1)抗菌药物的配制:抗菌药物原液均配制成4 000 μ g/mL, 试验中采用倍比稀释法稀释至所需浓度, 最终试验浓度2560.062 5 μ g/mL。头孢哌酮-舒巴坦中头孢哌酮、舒巴坦的配制比例为2 ∶ 1, 复方磺胺甲口恶唑中磺胺甲口恶唑与甲氧苄啶比例为9∶ 1, 哌拉西林-他唑巴坦中哌拉西林浓度2560.062 5 μ g/mL, 他唑巴坦为4 μ g/mL; (2)菌液制备:取培养过夜的纯菌落, 用生理盐水调至0.5麦氏单位浊度, 再稀释10倍, 取1 μ L用于接种。35 ℃孵育2024 h, 观察结果; (3)分析:用WHONT5软件分析结果。
2. 外排泵表型检测 按照琼脂稀释法操作规程, 测定在加入20 μ g/mL外排泵抑制剂Phe-Arg-beta-Naphthylamide (PAβ N)时细菌对亚胺培南MIC的变化, 当在加入PAβ N后, 亚胺培南的MIC下降≥ 4倍, 可以判读为外排泵表型阳性[1]。
3. PFGE 取培养过夜的细菌制备1%低熔点胶, 54 ℃蛋白酶K消化3 h, 水、三羟甲基氨基甲烷(Tris)-乙二胺四乙酸(EDTA)缓冲液(TE)各洗涤3次, 40 U限制性内切酶Apa I于37 ℃酶切3 h, 电泳条件:温度14 ℃, 电压6 V/cm, 夹角120° , 脉冲时间520 s, 电泳19 h。电泳后溴化乙啶(EB)染色, 紫外灯观察结果。分型参照参考文献[2]。
4. DNA模板提取 从血平板上挑取34个受试菌落于300 μ L 0.85%的生理盐水中, 制成细菌悬液, 混匀。9 500× g离心5 min; 弃上清液, 加入300 μ L无菌双蒸水, 混匀。细菌悬液100 ℃水浴, 15 min后14 000× g离心2 min, 取上清液即为DNA模板。
5. PCR扩增外排泵基因 采用Primer5设计引物, 见表1。总反应体系为50 μ L, 其中10× 缓冲液(含MgCl2) 14 μ L, dNTPs (各2.5 mmol/L)mixture 1 μ L, DNA模板 2.5 μ L, 上下游引物(10 μ mol/L)各0.5 μ L, Taq酶0.5 μ L, dH2O 31 μ L。反应条件:94 ℃预变性5 min, 然后94 ℃变性 30 s, 52 ℃复性50 s, 72 ℃延伸1 min, 共30个循环, 最后72 ℃延伸7 min。PCR产物经 1.2% 的琼脂糖凝胶(含EB)电泳观察特异性扩增条带。
| 表1 PCR反应引物 |
6. 测序 由上海闪晶分子生物科技有限公司协助完成。
采用SAS 8.0统计软件对耐药率、基因检出率进行统计分析, 统计方法采用χ 2检验, P< 0.05表示差异有统计学意义。
50株IRAB中MIC50> 128 μ g/mL的抗菌药物有阿米卡星、环丙沙星、哌拉西林-他唑巴坦、头孢哌酮、头孢西丁、四环素和复方磺胺甲口恶唑, MIC50在32128 μ g/mL的抗菌药物有美罗培南、头孢哌酮-舒巴坦、头孢吡肟、头孢他啶、头孢曲松、头孢噻肟, MIC50< 8 μ g/mL的抗菌药物有左氧氟沙星和多黏菌素B。30株ISAB对头孢西丁耐药率最高, MIC50为256 μ g/mL, MIC50< 8 μ g/mL 的药物有美罗培南、阿米卡星、头孢哌酮-舒巴坦、头孢他啶、头孢吡肟、多黏菌素B。统计学分析显示, IRAB与ISAB除对头孢吡肟、头孢西丁、多黏菌素B耐药性较一致外, 对其他抗菌药物耐药性差异均有统计学意义(P< 0.01), 见表2。
| 表2 IRAB和ISAB耐药性比较 |
加入外排泵抑制剂PAβ N, 50株IRAB中, 33株(66%)对亚胺培南的MIC有432倍的降低, 可认为外排泵表型阳性; ISAB外排泵表型全为阴性, 仅部分菌株MIC有2倍降低。
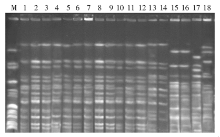
80株细菌可分为7型, 其中A型为主要克隆株。A型共67株(83.8%), 又分为8个亚型, 分布在监护室、呼吸科、肝移植科、神经内科、神经外科、血液科、普外科、胸外科和消化科; B型分2个亚型共5株, 分布于呼吸科、神经外科和肝移植科; C型3株; D型2株; E、F、G型各1株, 电泳图见图1。
IRAB中, adeB、adeJ、abeM基因检出率分别为94%、90%、80%, adeR、adeS的检出率均为86%, 即有4株adeB阳性而adeRS阴性的菌株。IRAB与ISAB相比, 各种外排泵基因检出率差异有统计学意义(P< 0.01), 见表3。
| 表3 主动外排基因在鲍曼不动杆菌中的分布 |
将PCR扩增产物纯化后进行测序, 测序结果经Blast比对, adeB、adeR、adeS、adeJ、abeM与GenBank相关基因同源性分别为100%、99%、99%、100%、99%。
碳青霉烯类抗菌药物亚胺培南一直被认为是临床上控制鲍曼不动杆菌感染最有效的抗菌药物。自1994年美国纽约首次报道碳青霉烯类耐药的鲍曼不动杆菌[3]之后, 世界各地陆续有报道。鲍曼不动杆菌一旦对碳青霉烯类抗菌药物耐药, 往往会对其他抗菌药物也耐药, 成为临床治疗的一大难题。本研究也证实, 对亚胺培南耐药菌株对美罗培南、氨基糖苷类、喹诺酮类、二三代头孢菌素、磺胺类耐药率均较高。含酶抑制剂的头孢哌酮-舒巴坦效果优于单纯的头孢哌酮, 这与以往报道基本一致[4]。统计学分析显示, IRAB与ISAB相比, 对头孢吡肟、头孢西丁、多黏菌素B耐药性较一致, 对其他抗菌药物耐药率差异有统计学意义。这提示我们临床用药要针对每位患者的药物敏感性试验结果选择合适的抗菌药物。
PFGE结果显示, 仁济医院鲍曼不动杆菌流行主要以A型(83.8%)克隆播散为主, 说明仁济医院鲍曼不动杆菌感染主要由医院感染所致。克隆株在病房内以及病房间的克隆播散已经成为全球性的问题, 是造成耐药菌株不断增加的重要原因。这提醒医务工作者在临床诊治过程中要注意无菌操作, 防止耐药株进一步扩散。
外排泵介导的药物主动外排系统是鲍曼不动杆菌耐药的一个重要原因, 近年来逐渐引起研究者的关注, 但目前国内研究还较少。本研究发现, 在使用外排泵抑制剂后, 66%的IRAB其MIC有了4倍或4倍以上降低, 可认为外排泵表型阳性, 而ISAB无明显变化, 提示外排泵表达增强是仁济医院鲍曼不动杆菌对亚胺培南耐药的重要原因。目前在不动杆菌属中发现的主动外排泵包括AdeABC、AdeIJK、AbeM。AdeABC和AdeIJK均是RND家族外排泵, AdeABC可引起对β -内酰胺类、氨基糖苷类、喹诺酮类、四环素、红霉素、氯霉素、甲氧苄啶、替加环素等耐药, AdeIJK则可能在天然、低水平耐药中发挥着更重要的作用, 其底物包括β -内酰胺类、林克酰胺类、氟喹诺酮类、四环素类、氯霉素、红霉素、利福平等[5]。AbeM为MATE家族的成员, 由Su等[6]最先报道, 可引起对喹诺酮类、红霉素、氯霉素等耐药。本研究中, 50株IRAB, adeB、adeJ、abeM阳性率分别为94%、90%、80%, 而ISAB相应阳性率分别为43%、60%、50%, 二者相比, 差异有统计学意义。我们在研究中发现4株adeB阳性而adeRS阴性的菌株, 其耐药性明显低于adeRS阳性的菌株, 这可能与adeRS对adeB基因表达的调控有关。
50株IRAB中有33株外排泵表型阳性、17株阴性, 两者相比, 外排泵阳性株更易表现为多重耐药, 且MIC值明显高于外排泵阴性株。PCR结果显示, 外排泵阳性株均含有adeB基因, 并有25株同时含有adeB、adeJ、abeM 3种外排泵基因。而外排泵表型阴性菌株中多为仅含1种或2种外排泵基因。
本研究显示, 仁济医院鲍曼不动杆菌存在播散流行, 其对亚胺培南耐药由多种机制介导, AdeABC、AdeIJK、AbeM外排泵广泛存在于耐药株中, 其表达水平、调控机制及相互作用我们还将做进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|