通讯作者:姜怡邓,联系电话:0951-4086310。
作者简介:马琳娜,女,1985年生,学士,从事动脉粥样硬化与分子生物学研究。
探讨同型半胱氨酸(Hcy)对THP-1单核细胞源性泡沫细胞形成中三磷酸腺苷-结合转运子A1(ABCA1)和酰基辅酶A:胆固醇酰基转移酶(ACAT1)表达的影响。
方法将THP-1单核细胞与佛波酯(PMA)、氧化低密度脂蛋白(ox-LDL)共同培养,复制泡沫细胞模型,并分别用50、100、200、500 μmol/L Hcy和100 μmol/L Hcy+叶酸+维生素B12(Vit B12)干预72 h,并设对照组(不加入Hcy)。采用油红O染色检测泡沫细胞的形成。采用酶终点法测定细胞内总胆固醇(TC)、游离胆固醇(FC)和胆固醇酯(CE)含量的变化,观察Hcy对泡沫细胞CE流出的影响。采用荧光定量逆转录-聚合酶链反应 (RT-PCR)测定ABCA1、ACAT1 mRNA表达;免疫印迹法检测ABCA1、ACAT1蛋白表达。
结果油红O染色显示Hcy加剧了泡沫细胞的形成,但不呈量效关系。实验组(加入50、100、200、500 μmol/L Hcy和100 μmol/L Hcy+叶酸+Vit B12)泡沫细胞阳性百分率均高于对照组( P<0.05、 P<0.01),以100 μmol/L Hcy组效应最为明显( P<0.01)。在Hcy的干预下,泡沫细胞胞内TC、FC、CE流出减少,与对照组比较差异有统计学意义( P<0.05),以100 μmol/L Hcy组效应最为明显( P<0.01)。100 μmol/L Hcy+叶酸+VitB12组与100 μmol/L Hcy组比较,前者泡沫细胞形成减少,胆固醇流出增多。RT-PCR结果显示ABCA1 mRNA表达下调,ACAT1 mRNA表达上调,均以100 μmol/L Hcy组效应最为明显( P<0.01);免疫印迹法检测ABCA1、ACAT1蛋白的表达与其mRNA表达一致。
结论Hcy下调了ABCA1的表达,上调了ACAT1的表达,促使了泡沫细胞形成。
To investigate the influence of homocysteine(Hcy) on the expressions of ATP-binding cassette transporter A1(ABCA1) and acylcoenzyme A: cholesterol acyltransferase-1 (ACAT1) in the formation of THP-1 monocyte-derived foam cells.
MethodsTHP-1 monocytes were cultured with phorbol myristate acetate(PMA) and oxidized low density lipoprotein(ox-LDL) so as to copy foam cell model, and then intervened by 50, 100, 200 and 500 μmol/L Hcy and 100 μmol/L Hcy+folic acid+vitamin B12(Vit B12) for 72 h. The control group(not intervened by Hcy) was set. The formation of foam cells was analyzed by the oil red O staining. The intracellular total cholesterol(TC), free cholesterol(FC) and cholesterol ester(CE) of foam cells were measured by enzymatic end point determination in order to observe the effects of Hcy on foam cell CE efflux. Fluorescence quantitative reverse transcription polymerase chain reaction(RT-PCR) detected the expressions of ABCA1 mRNA and ACAT1 mRNA. Western blotting tested the expressions of ABCA1 protein and ACAT1 protein.
ResultsAfter the intervention of Hcy, oil red O staining showed that the formation of foam cells was increased significantly, but not in dose-effect relationship. The positive percentage of experimental group (50, 100, 200 and 500 μmol/L Hcy and 100 μmol/L Hcy+folic acid+Vit B12) was higher than that of control group ( P<0.05, P<0.01). The 100 μmol/L Hcy group was the most significant one( P<0.01). The outflow of foam intracellular TC, FC and CE was reduced significantly compared with control group( P<0.05), and the 100 μmol/L Hcy group was the most significant one ( P<0.01). The 100 μmol/L Hcy+folic acid+Vit B12 group showed that the formation of foam cells was decreased, whereas the cholesterol efflux was increased compared with 100 μmol/L Hcy group. RT-PCR showed that the expression of ABCA1 mRNA was decreased, but ACAT1 mRNA was increased, and the 100 μmol/L Hcy group was the most significant effect one( P<0.01). Western blotting showed that the expressions of ABCA1 protein and ACAT1 protein were consistent with mRNA expression.
ConclusionsHcy reduces the expression of ABCA1, in the contrast, the expression of ACAT1 is increased. Both of them promote the formation of foam cells.
三磷酸腺苷-结合转运子A1(ATP-binding transporter A1, ABCA1)在胆固醇的代谢过程中起到了举足轻重的作用, 在胆固醇逆向转运(reverse cholesterol transport, RCT)中, 相当于限速酶[1], 调节着HDL的产生和迁移, 保护心血管, 具有重要的抗动脉粥样硬化(atherosclerosis, AS)功能。同时, 在AS的形成及胆固醇代谢异常的过程中, 酰基辅酶A:胆固醇酰基转移酶(acylcoenzymeA:cholesterolacyltransferase, ACAT1)是细胞内惟一催化胆固醇与长链脂肪酸酯化形成胆固醇酯(cholesterol ester, CE)的酶, 调节着游离胆固醇(free cholesterol, FC)和CE之间的平衡, 单核细胞内主要以ACAT1形式存在[2]。胆固醇的代谢异常将导致巨噬细胞内胆固醇的沉积, 从而形成泡沫细胞, 而泡沫细胞是AS形成和发展中的关键环节。目前, 高同型半胱氨酸血症(hyperhomocysteinemia, HHcy)已被公认为是致AS的一个主要独立危险因子, 但同型半胱氨酸(homocysteine, Hcy)是否会导致THP-1单核细胞源性泡沫细胞中ACAT1和ABCA1这2个基因的异常表达, 从而引起胆固醇代谢的紊乱, 并最终导致AS的发生发展, 这方面罕见报道。我们旨在通过对在Hcy的参与下泡沫细胞的形成和胆固醇的流出进行检测, 观察其变化特点, 并且通过荧光定量逆转录-聚合酶链反应(RT-PCR)和免疫印迹法检测ABCA1、ACAT1的表达, 进一步从转录和翻译阶段明确Hcy对THP-1单核细胞源性泡沫细胞形成中ABCA1、ACAT1表达的影响。
干粉末RPMI-1640培养基(美国GIBCO公司); 胎牛血清(杭州四季青生物工程材料研究所); Hcy、油红O、佛波酯(PMA)(美国Sigma公司); ox-LDL(上海生物研究所); 总胆固醇(TC)试剂盒、FC试剂盒(北京北化康泰临床试剂有限公司) ; 考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所); 西班牙琼脂糖(北京博菲康生物技术有限公司); THP-1单核细胞株(四川大学华西医学院); 6孔板(美国corning costar公司); 引物由上海生工生物工程有限公司合成, ABCA1上游引物:5'-GTCCTCTTTCCCGCATTA-3', 下游引物:5'-CTTGTTCACCTC AGC CAT-3'; ACAT1上游引物:5'-GCAGGCTTACCTATTTCT-3', 下游引物:5'-GCAGGCTTA CCTATTTCT-3'; GAPDH上游引物:5'-AGAAGGCTGGGGCTCATTTG-3', 下游引物:5'-AGGGGCCATCCACAGTCTTC-3'; RT-PCR试剂盒(美国Invitrogen公司); ABCA1兔抗人一抗、ACAT1兔抗人一抗、辣根过氧化物酶(HRP)标记的羊抗兔二抗 (北京博奥森生物技术有限公司)。
Tn-S倒置显微镜(日本Nikon公司); SW-CJ-2F型超净工作台(苏州安泰空气技术有限公司); FTC-3000型荧光定量PCR仪(上海枫岭生物技术有限公司); PROTEANⅡ xi型垂直电泳仪(美国Bio-Rad公司); 5415D型微量台式离心机(德国Eppendorf 公司); HERAcell150型CO2孵箱(德国Heraeus公司); Mode l680型全自动酶标仪(美国Bio-Rad公司); BS110S型精密天平(德国赛多利斯Sartorius公司); 4330型PH测定仪(Jenway公司)等。
1. THP-1单核细胞的培养、泡沫细胞形成和鉴定 THP-1单核细胞加入含15%小牛血清的RPMI-1640培养基, 置37 ℃、5%CO2孵育箱传代培养, 以4× 106个/mL接种于25 cm2培养瓶, 加入终浓度为500 μ mol/L的PMA, 37 ℃、5%CO2培养48 h, 显微镜下观察细胞贴壁状态, 证实THP-1细胞已分化为巨噬细胞。弃去旧培养液, 更换为含不同Hcy浓度的RPMI-1640培养基(含终浓度为50 mg/L的ox-LDL)培养24 h, 观察泡沫细胞的形成并用于后续实验。
2. 实验分组 (1)对照组:单核细胞+PMA+ox-LDL(泡沫细胞), 不加入Hcy; (2)实验组:在泡沫细胞中分别加入50、100、200、500 μ mol/L Hcy和100 μ mol/L Hcy+叶酸+Vit B12的完全培养基孵育细胞, 每组3瓶。
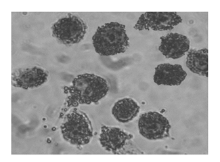
3. 油红O染色和泡沫细胞计数 将干预后的泡沫细胞用PBS洗3次, 10%甲醛固定10 min, 60%乙醇浸泡1 min后, 油红O染色30 min, 双蒸水洗5 min, 再用苏木素染色5 min, 最后用双蒸水洗, 待干后甘油明胶封片, 镜下观察。按Wada方法进行脂质染色的半定量分析, 即根据细胞脂滴的面积进行细胞分类。细胞脂滴的面积< 细胞核的面积记为“ -” ; 细胞脂滴的面积≥ 细胞核的面积记为“ +” , 即为泡沫细胞。每一块玻片计数100个细胞, 计算泡沫细胞的阳性率。
4. 细胞内胆固醇含量的分析 用橡皮刮子刮下干预后的泡沫细胞, PBS洗涤3次, 重悬于0.5 mL磷酸钠缓冲液(pH值> 7.4)中, 超声波裂解细胞1 min。按试剂盒说明书采用酶学反应终点法在酶标仪上检测TC浓度。以考马斯亮蓝G-250法测定各样本中蛋白质含量。细胞内胆固醇的含量用每mg蛋白所含的胆固醇量表示(μ g/mg.pro), 另测定FC的含量, CE含量=TC-FC。
5. 荧光定量RT-PCR检测ABCA1 mRNA、ACAT1 mRNA表达 取THP-1单核细胞及诱导的各组泡沫细胞, Trizol提取RNA, 检测RNA的完整性。12.5 μ L逆转录体系, 逆转录合成cDNA。取逆转录产物1.5 μ L, 上、下游引物各1 μ L, 5× Reaction Buffer 4 μ L, RiboLockTMRNase Inhibitor(20 U/μ L)1 μ L, 10 mmol/L dNTP Mix 2, RevertAidTMM-MuLV Reverse Transcriptas (200 U/μ L) 1 μ L, 加入无RNA酶水补足20 μ L。94 ℃ 10 min, 94 ℃ 15 s, 51 ℃ 30 s, 72 ℃ 30 s, 共50个循环, 内参GADPH共扩增25个循环。通过实时荧光定量PCR仪进行分析。根据目的基因的相对量=2-△ △ Ct计算结果, △ △ Ct = [CtGI(待测样本)-CtGAPDH(待测样本)]-[CtGI(校正样本)-CtGAPDH (校正样本)]。
6. 免疫印迹法 检测ABCA1、ACAT1蛋白表达 细胞裂解法提取THP-1单核细胞及诱导的各组泡沫细胞, 各组样本分别取总蛋白20 μ L, 经6%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后转膜, 与特异性一抗(兔抗人ABCA1、ACAT1多克隆抗体)37 ℃温育2 h, 4 ℃过夜。与二抗(含HRP标记的羊抗兔IgG)室温孵育1 h后, 加入显色底物, 暗室显色2 min, 曝光X线片。设β -actin为内参, 凝胶成像分析仪上成像分析, 计算ABCA1、ACAT1与β -actin内参灰度值的比值, 进行分析。
结果以
Hcy干预后泡沫细胞的形成有了明显增加, 但与Hcy浓度不呈量效关系。实验组(加入50、100、200、500 μ mol/L Hcy和100 μ mol/L Hcy+叶酸+Vit B12)阳性细胞百分率(%)均高于对照组 (P< 0.05、P< 0.01), 其中以100 μ mol/L Hcy组阳性细胞百分率最高 (P< 0.01), 见表1。
| 表1 油红O染色阳性细胞的百分计数 |
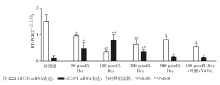
Hcy干预后, 泡沫细胞胞内胆固醇的聚集明显增加, 但与Hcy浓度不呈量效关系。实验组与对照组比较差异有统计学意义(P< 0.05、P< 0.01), 以100 μ mol/L Hcy最为明显 (P< 0.01), 是对照组的2.46倍; 而100 μ mol/L Hcy +Vit B12+叶酸组泡沫细胞内胆固醇的含量较少。见图2。
实验组ABCA1 mRNA的表达均下降, 与对照组比较差异有统计学意义(P< 0.05、P< 0.01), 其中100 μ mol/L Hcy组细胞ABCA1 mRNA表达最低(P< 0.01), 仅为对照组的22.3%, 见图3(a)、图4。随着Hcy浓度的增加, ABCA1 mRNA表达不呈量效依赖关系。免疫印迹法结果显示, ABCA1蛋白表达水平与ABCA1 mRNA表达水平一致, 见图5(a)、图6。
实验组ACAT1 mRNA表达上调, 与对照组比较差异有统计学意义(P< 0.05、P< 0.01), 其中100 μ mol/L Hcy组细胞ACAT1 mRNA表达最高(P< 0.01), 见图3(b)、图4。随着Hcy浓度的增加, ACAT1 mRNA表达不呈量效依赖关系。免疫印迹法结果显示, ACAT1蛋白表达水平与ACAT1 mRNA表达水平一致, 见图5(b)、图6。
AS在心血管疾病发生发展过程中是一个重要的特征性基础病变。心脑血管疾病是世界范围的主要死因之一[3]。HHcy已被公认为是致AS的一个主要独立危险因子[4, 5]。在AS的形成过程中, 脂代谢异常也是一个很重要的环节, ABCA1和ACAT1在此环节中扮演了重要的角色。从大量文献[6, 7, 8, 9]可以看出这2个基因对胆固醇的代谢调节作用是相反的。胆固醇的代谢紊乱导致了巨噬细胞内胆固醇的沉积, 即形成泡沫细胞, 最终导致AS的发生发展。那么Hcy是如何影响ABCA1和ACAT1的表达, 进而如何调控泡沫细胞的形成还有待研究。
本研究分别从泡沫细胞的形成、细胞内胆固醇的流出、ABCA1及ACAT1 mRNA表达和蛋白质表达水平探讨了Hcy对THP-1单核细胞源性泡沫细胞形成中ABCA1、ACAT1表达的影响。结果显示Hcy促进泡沫细胞形成, 增加了泡沫细胞内胆固醇的聚集。在未加入Hcy干预时, 泡沫细胞中ABCA1 mRNA表达量最高。这表明在巨噬细胞吞噬大量ox-LDL形成泡沫细胞的起始阶段, ABCA1代偿性增加, 不但参与形成前期高密度脂蛋白(HDL), 并且刺激自分泌信号产生, 减少了极低密度脂蛋白的生成, 促使胞内胆固醇外流, 具有AS的保护作用。可以推测体内HDL和甘油三酯(TG)的逆相关关系由ABCA1进行调节。这与国内、外大量研究结果一致[10, 11, 12, 13]。而在未加入Hcy时, 泡沫细胞中ACAT1 mRNA已经开始表达, 但表达量还很低。这表明, 在巨噬细胞形成泡沫细胞的过程中, ACAT1已开始促进胆固醇的堆积, 促使泡沫细胞的形成, 这是AS发病的关键环节。
随着Hcy浓度的增高, ABCA1 mRNA表达下降, 且在Hcy浓度为100 μ mol/L最低。表明此时ABCA1已失代偿, 功能发生障碍, 导致大量胆固醇在泡沫细胞内聚集, HDL含量减少, RCT途径失衡。而ACAT1 mRNA表达增多, 且在Hcy浓度为100 μ mol/L时最高。表明在Hcy的干预下, ACAT1被完全激活, 并充分发挥其催化胆固醇与长链脂肪酸酯化形成CE的作用, 使胆固醇代谢失衡。在ABCA1和ACAT1的共同作用下, 泡沫细胞大量形成, AS发生。随着Hcy浓度的进一步增高, ABCA1 mRNA和ACAT1 mRNA表达量并没有进一步变化。这是因为泡沫细胞的形成、AS的发生发展是一个多因素在多层次上、通过多基因调控的结果, 此现象的发生也许与其他调控途径有关。叶酸和Vit B12是Hcy的拮抗剂, 100 μ mol/L Hcy+叶酸+Vit B12组与100 μ mol/L Hcy组比较, ABCA1 mRNA表达量明显增高, ACAT1 mRNA表达量明显降低。进一步表明一定浓度的Hcy可使ABCA1 mRNA表达下调, ACAT1 mRNA表达上调, 是促进胆固醇在细胞内聚集的重要因素。ABCA1、ACAT1的蛋白表达和其mRNA表达一致, 即翻译和转录一致。
ABCA1和ACAT1是调节细胞内胆固醇外流的2个关键基因, 其在胆固醇调节的过程中作用相反, Hcy通过抑制ABCA1表达, 促进ACAT1表达, 导致细胞内胆固醇的蓄积, 进而促使泡沫细胞的形成, 促进AS的发生、发展。若能从转录阶段介导ABCA1和ACAT1的表达, 将为预防和治疗Hcy致AS提供新思路, 为进一步研究AS的发病机制提供理论基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|