通讯作者:应春妹,联系电话:021-58752345-3299。
作者简介:杜坤,男,1985年生,学士,主要从事细菌耐药机制研究。
了解上海地区4家医院2010年鲍曼不动杆菌对13种抗菌药物耐药性及β-内酰胺酶基因携带情况,研究该菌的流行型别,为临床合理用药及控制医院感染提供依据。
方法收集上海4家医院临床分离的鲍曼不动杆菌共204株。采用琼脂稀释法检测上述细菌对13种抗菌药物的最低抑菌浓度(MIC),三维试验检测AmpC酶,乙二胺四乙酸(EDTA)纸片协同试验检测金属酶表型。聚合酶链反应(PCR)检测 OXA-23、 OXA-24、 OXA-51、 OXA-58、 ampC、 IMP-1、 IMP-4、 VIM-2编码基因。
结果4家医院鲍曼不动杆菌对环丙沙星、哌拉西林-他唑巴坦、头孢西丁、复方磺胺甲口恶唑、头孢哌酮耐药率均较高,达到90%以上;对左氧氟沙星、多黏菌素B耐药率均相对较低。研究发现浦东地区医院对美罗培南、左氧氟沙星、多黏菌素B的耐药率均高于浦西地区医院。AmpC酶表型检测以公利医院表型阳性率最高(84.6%),瑞金医院表型阳性率最低(42.3%);金属酶表型检测,公利医院和仁济医院西院未检测到金属酶表型阳性菌株,另外3家医院中以东方医院检出率最高(27.3%),瑞金医院检出率最低(7.7%)。基因检测,浦东地区医院的 OXA-23和 ampC阳性率要比浦西地区医院的阳性率高。204株菌株 OXA-51均为阳性,均未检测到 OXA-24、 OXA-58、 IMP-1基因。在仁济医院东院和东方医院标本中检测到 IMP-4和 VIM-2基因,其他医院标本未检测到 IMP-4和 VIM-2基因。
结论本地区分离到的鲍曼不动杆菌均检测出 OXA-51,上海地区不同医院之间鲍曼不动杆菌产β-内酰胺酶情况略有不同。
To understand the resistance to 13 antibiotics and beta-lactamase genes in Acinetobacter baumannii in Shanghai 4 hospitals in 2010, and investigate the epidemic types, so as to provide the reference for rational use of antibiotics and control of nosocomial infections.
MethodsThe 204 isolates of Acinetobacter baumannii were collected from clinical specimens of 4 hospitals. Agar dilution was performed to determine the minimum inhibitory concentrations (MIC) to 13 antibiotics. Three dimensional extract test and ethylene diamine tetraacetic acid (EDTA) disc were carried out to screen AmpC enzyme and metal enzyme, respectively. OXA-23, OXA-24, OXA-51, OXA-58, ampC, IMP-1, IMP-4 and VIM-2 coding genes were amplified by polymerase chain reaction (PCR).
ResultsThe resistance rates of these strains to ciprofloxacin, piperacillin-tazobactam, cefoxitin, sulfamethoxazole and cefoperazone were higher than 90%. The resistance rates of strains to levofloxacin and polymyxin B were relatively low. The resistance rates of the hospitals in Pudong to meropenem, levofloxacin and polymyxin B were higher than those of the hospitals in Puxi. The results of the three dimensional extract test showed that the positive rate of Gongli Hospital was the highest (84.6%), and the positive rate of Ruijin Hospital was the lowest (42.3%). The results of metal enzyme phenotype testing showed that Gongli Hospital and Renji Hospital(West) did not detect the positive strains of metal enzyme phenotype, in the other 3 hospitals, the highest positive rate (27.3%) was detected in East Hospital, and the positive rate of Ruijin Hospital was the lowest (7.7%). The results of PCR amplification showed that the positive rate of Pudong hospitals was higher than that of Puxi hospitals for OXA-23 and ampC. OXA-51 were all positive in all strains,and OXA-24, OXA-58 and IMP-1 were all negative. IMP-4 and VIM-2 were detected at Renji Hospital(East) and East Hospital, while they were not detected in Gongli Hospital, Ruijin Hospital and Renji Hospital(West).
ConclusionsOXA-51 is detected in the isolates of Acinetobacter baumannii, and there is slight difference between different hospitals in the mechanism of Acinetobacter baumannii beta-lactamases.
不动杆菌是医院感染常见病原菌, 该菌广泛存在于自然界、医院及人体皮肤, 为常见条件致病菌。鲍曼不动杆菌主要引起医院获得性肺炎、败血症、尿路感染、伤口感染、脑膜炎以及免疫受损、术后患者感染。鲍曼不动杆菌对许多抗菌药物, 如β -内酰胺类、氨基糖苷类、喹诺酮类均有一定的耐药性, 但近年来由于抗菌药物在临床过度使用, 鲍曼不动杆菌耐药性呈上升趋势, 尤其是出现了碳青霉烯类耐药菌株, 给临床治疗带来很大挑战[1, 2]。产β -内酰胺酶是鲍曼不动杆菌对β -内酰胺类抗菌药物耐药的重要原因, 本研究分别收集上海地区4家医院[东方医院、公利医院、仁济医院(东院、西院)、瑞金医院]204株临床分离的鲍曼不动杆菌, 用琼脂稀释法检测13种抗菌药物对其最低抑菌浓度(MIC)及产β -内酰胺酶情况, 并对这4家医院耐药性进行比较, 了解鲍曼不动杆菌的流行型别和不同医院抗菌药物用药情况, 以指导临床医生合理使用抗菌药物。
1. 菌株来源 收集上海4家医院临床分离的鲍曼不动杆菌共204株, 其中东方医院33株(2010年8、9月份标本), 公利医院13株(2010年7、8月份标本), 仁济医院东院102株(2010年2至10月份标本), 瑞金医院26株(2010年 10月份标本), 仁济医院西院30株(2010年 10月份标本), 标本分别来自痰液、引流液、尿液、血液、脑脊液、脓液、咽拭子、胆汁、插管等, 去除同一患者重复标本。所有菌株经VITEK-32细菌鉴定仪(法国生物梅里埃公司)鉴定。质控菌株为大肠埃希菌(ATCC 25922)。
2. 抗菌药物 阿米卡星、环丙沙星、左氧氟沙星、头孢他啶、头孢西丁、头孢哌酮、他唑巴坦、舒巴坦、磺胺甲口恶唑、甲氧苄啶、美罗培南、多黏菌素B等抗菌药物制剂购自上海科佳药检器材公司。头孢吡肟由中美上海施贵宝制药有限公司惠赠, 亚胺培南由默沙东制药有限公司惠赠, 哌拉西林由华山医院抗生素研究所惠赠。
3. 试剂 Taq DNA 聚合酶、10× 聚合酶链反应(PCR)缓冲液(含MgCl2)、dNTPs mixture为大连宝生物科技有限公司产品。水解酪蛋白胨(MH)琼脂为Oxoid公司产品。
4. 仪器 PCR扩增仪为美国ABI公司产品, 凝胶成像仪为上海天能科技有限公司产品。
1. 抗菌药物MIC检测 用琼脂稀释法检测204株鲍曼不动杆菌对13种抗菌药物的MIC。试验方法及结果判断标准参照2009年美国临床实验室标准化协会(CLSI)标准判断药敏结果[3]。(1)抗菌药物配制:抗菌药物原液均配制成40 000 mg/L, 试验中采用倍比稀释法稀释至所需浓度, 最终试验浓度2561 mg/L。头孢哌酮-舒巴坦中头孢哌酮、舒巴坦的配制比例为 1∶ 1, 哌拉西林-他唑巴坦中哌拉西林、他唑巴坦的比例为8∶ 1, 复方磺胺甲口恶唑中磺胺甲口恶唑与甲氧苄啶比例为5∶ 1; (2)菌液制备:取培养过夜的纯菌落, 用生理盐水调至0.5麦氏单位浊度, 再稀释10倍, 取1 μ L用于接种。35 ℃孵育20~24 h, 观察结果。
2. AmpC酶表型检测 参照Coudron等[4]报道的三维试验方法。(1)酶粗提物制备:挑取血平板上已纯培养18~24 h的菌株3~5个, 接种于营养肉汤, 35 ℃培养6 h左右, 定时混匀, 880× g离心30 min, 弃上清, 沉淀于-80 ℃和35 ℃反复冻融8次(每次要冻2 h以上再取出融化), 加入0.01 mol磷酸盐缓冲液(PBS, pH值7.0), 4 ℃ 5 500× g离心20 min, 上清液即为酶提取物; (2)三维试验:将0.5麦氏单位浓度的大肠埃希菌(ATCC 25922)菌液涂布于MH平板上, 取一头孢西丁药敏纸片贴在平板中心, 用无菌刀片在离纸片边缘5 mm处切一小槽, 在小槽内加入 50 μ L酶提取物, 35 ℃培养过夜观察结果。当抑菌圈不完整, 小槽近头孢西丁纸片端与抑菌圈交接处出现向平皿中心扩大的长菌区者为AmpC酶阳性, 抑菌圈完整者为阴性[5], 见图1。
3. 乙二胺四乙酸(EDTA)纸片协同试验 按照纸片扩散法药物敏感性试验操作规程, 将细菌配成0.5麦氏单位浓度, 均匀涂布在MH琼脂平皿上, 分别贴2张亚胺培南药敏纸片, 2张纸片中心相距> 25 mm。在其中1张纸片上滴加5 μ L 500 mmol/L (pH值8.0) EDTA溶液。35 ℃培养20 h观察结果。亚胺培南+EDTA纸片与单纯亚胺培南纸片的抑菌圈直径之差≥ 7 mm为金属酶阳性[6], 见图2。
4. 模板制备 用煮沸法提取质粒DNA:从MH平板上挑取3~4个菌落于300 μ L 0.85%的生理盐水中, 制成细菌悬液, 混匀。5 500× g离心5 min, 弃上清, 加300 μ L无菌双蒸水, 混匀。细菌悬液100 ℃水浴, 15 min后离心, 7 900× g离心2 min, 取上清液即为DNA模板。
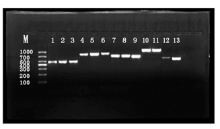
5. PCR扩增 总反应体系为50 μ L, 其中10× 缓冲液(含MgCl2) 5 μ L, dNTPs (各2.5 mm/L)mixture 4 μ L, DNA模板 3 μ L, 上下游引物(20 μ mol/L)各1 μ L, Taq酶(5 U/μ L)0.25 μ L, dH2O 36 μ L。反应条件:94 ℃预变性5 min, 然后94 ℃变性30 s, 55 ℃复性30 s(OXA-51为52 ℃复性50 s), 72 ℃延伸1 min, 共30个循环, 最后72 ℃延伸7 min。PCR产物经1.2%的琼脂糖凝胶[含溴化乙啶(EB)]电泳观察特异性扩增条带, 见图3。
6. 测序 由上海闪晶分子生物科技有限公司协助完成, 结果用基因库中的Blast程序进行同源分析。
4家医院的菌株对环丙沙星、哌拉西林-他唑巴坦、头孢西丁、复方磺胺甲口恶唑、头孢哌酮耐药率均较高, 达到90%以上, 其中对头孢西丁耐药率最高, 对左氧氟沙星、多黏菌素B耐药率均相对较低, 对多黏菌素B尤其敏感。其中浦东地区3家医院鲍曼不动杆菌对美罗培南、左氧氟沙星、多黏菌素B的耐药率均显著高于浦西地区医院, 见表1和表2。
| 表1 上海浦东地区3家医院耐药性结果 |
| 表2 上海浦西地区2家医院耐药性结果 |
浦东地区医院OXA-23阳性率较浦西地区医院阳性率高。浦东地区医院ampC阳性率比浦西地区医院高。204株菌株OXA-51均为阳性, 均未检测到OXA-24、OXA-58、IMP-1基因, 仁济医院东院和东方医院检测到IMP-4和VIM-2基因, 并且出现了IMP-4和VIM-2基因同为阳性的菌株, 公利医院、瑞金医院、仁济医院西院未检测出IMP-4和VIM-2基因, 见表5、表6。
| 表5 PCR 扩增基因型及引物序列 |
| 表6 上海地区4家医院基因检测结果 |
将PCR扩增产物纯化后进行测序, 测序结果经Blast比对, OXA-23、OXA-51、ampC、 IMP-4、VIM-2与GenBank相关基因同源性分别为100%、99%、99%、100%、100%。
鲍曼不动杆菌是引起医院感染的常见病原菌, 其耐药性强, 耐药谱广, 对多种抗菌药物耐药。临床上亚胺培南等碳青霉烯类抗菌药物是治疗鲍曼不动杆菌感染的有效药物, 但鲍曼不动杆菌对这类抗菌药物的耐药率也逐年上升。本研究对上海不同地区的鲍曼不动杆菌耐药性检测发现, 菌株同时对氨基糖苷类、喹诺酮类、头孢菌素类、磺胺类等抗菌药物耐药性较高, 对多黏菌素B敏感, 含酶抑制剂头孢哌酮-舒巴坦的抑菌效果略优于单独头孢哌酮, 这与之前学者研究结果较一致 [7]。产β -内酰胺酶是鲍曼不动杆菌对β -内酰胺类抗菌药物耐药的重要原因之一。按照Ambler分类方法, β -内酰胺酶分A、B、C、D 4类。
A类酶, 主要是超广谱酶, 如SHV、TEM、PER、CTX等。B类酶, 称为金属β -内酰胺酶, 对β -内酰胺类抗菌药物具有广泛的水解作用, 目前认为鲍曼不动杆菌对碳青霉烯类抗菌药物耐药机制中最重要的是产金属β -内酰胺酶, 这类酶活性主要依赖二价锌离子, 故称金属酶, 是碳青霉烯酶的一种。该酶广泛水解多种β -内酰胺类抗菌药物, 对常用β -内酰胺酶抑制剂(如克拉维酸、舒巴坦等)不敏感, 但其活性可被金属螯合剂(如EDTA)抑制。近年来, 金属β -内酰胺酶在世界范围被广泛发现, 逐渐成为研究热点, 金属酶以IMP、VIM 型为主且可分为多种亚型, 此外还包括SPM、GIM、SIM 型等多种类型。本研究结果显示, 仁济医院东院和东方医院的鲍曼不动杆菌基因检测出金属酶阳性, 说明这2家医院的耐药机制中包括产金属酶。在本研究中表型检测阳性率高, 而PCR检测阳性率却较低, 结果相差较大, 国内学者也有相似结果报道[8], 可能原因是:首先, EDTA本身可抑制细菌生长而导致抑菌圈扩大, 故造成假阳性; 另外, EDTA可能对细菌的细胞壁破坏能力不够, 使酶释放不够; 最后, EDTA协同试验受纸片距离影响较大, 而且也会受到主观因素影响。PCR检测存在假阴性, 首先本研究只检测了5种金属酶基因型中以IMP、VIM 为主的2种, 可能有其他3种基因型存在, 并且每种基因型都有各自的多种亚型, 所以可能是其他未检测到的金属酶导致金属酶表型阳性, 这还有待进一步试验研究; 其次本研究提取DNA采用的是煮沸法提取质粒DNA, 是以质粒为模板的基因扩增, 受质粒提取过程及质量的影响, 可能有部分细菌携带有金属酶基因, 但在质粒提取中丢失了, 这些均可导致PCR检测阳性率低。也可以采用提取基因组DNA的方法提取DNA, 需要用到苯酚、氯仿、异戊醇等有毒试剂, 方法步骤较为繁琐, 受到的影响因素更多。煮沸法操作简单, 受到的影响因素较少, 是临床较常用的质粒DNA提取法。
C类酶, 即AmpC酶, 主要分解三代头孢菌素及单环酰胺类, 可被氯唑西林、Syn 2190抑制。诱导性产AmpC酶的革兰阴性菌有较高频率的自发突变[9], 突变可发生在amp操纵子上:(1)ampC基因突变或ampC基因扩增[10]; (2)ampC启动子和/或衰减子突变; (3)调节基因突变[11], 如ampR、ampD、ampE等, 导致AmpC酶活性或表达水平改变。临床分离株中, 突变最常见于ampD。ampD突变导致2种β -内酰胺酶表达:(1)无义突变造成去阻遏, 失去抑制作用, 称之为去阻遏合成(derepressed-beta-lactamases synthysis); (2)另一种突变产生诱导性高水平表达AmpC酶。法国Corvec等[12]研究发现鲍曼不动杆菌大多数为染色体介导去阻遏持续高产AmpC酶, 所以本研究主要检测持续高产型AmpC酶结构基因, 结合药敏结果和PCR结果可以看出, 位于浦西地区的瑞金医院和仁济西院阳性率相对浦东医院低, 而头孢吡肟、美罗培南、左氧氟沙星浦西地区医院相对浦东地区耐药率低, 我们推测AmpC基因的高检出率可能主要与头孢菌素类、喹诺酮类耐药有关。与三维试验结果比较, 我们发现PCR结果的阳性率较高, 可能原因是表型检测敏感性较差, 这很可能是三维试验操作过程中, 酶冻融不彻底, 使释放的酶量减少或可能与细菌膜孔蛋白缺失导致其对头孢西丁耐药有关, 其详细机制有待进一步研究。
D类酶, 又被称为苯唑西林酶[13], 是鲍曼不动杆耐药机制中主要的酶类。根据基因同源性不同, 又可分为4组:OXA-23、OXA-24、OXA-51、OXA-58。OXA-51广泛存在于鲍曼不动杆菌中, 常被认为是该菌的标志性基因, 可引起天然低水平耐药。本研究的204株鲍曼不动杆菌中, OXA-51也均为阳性。OXA-23是目前报道最多的β -内酰胺酶, 可引起对青霉素类、头孢菌素类、碳青霉烯类等多种抗菌药物耐药, 结合药敏结果和PCR结果, 我们发现浦东地区东方医院和仁济医院东院相对浦西地区医院的OXA-23阳性检出率高, 具有OXA-23基因通常对碳青霉烯类抗菌药物耐药, 浦东地区菌株美罗培南耐药率相对浦西地区有较明显提高, 而亚胺培南耐药率各医院差异不太明显, 这可能与不同医院抗菌药物使用习惯有关, 说明OXA-23可能是介导鲍曼不动杆菌对美罗培南耐药的因素, 之前有学者研究表明, 介导美罗培南耐药的重要机制包括外排泵机制[14], 而浦东地区和浦西地区在美罗培南耐药率上的差异说明这2个地区鲍曼不动杆菌在外排泵基因表达水平上可能有差异, 需做进一步研究论证。
本研究检测出浦东地区医院存在IMP-4基因和VIM-2基因, 之前产金属酶鲍曼不动杆菌在浦东地区医院中鲜有报道, 金属酶基因在浦东地区医院中出现, 提示各个医院须严格管理本院碳青霉烯类抗菌药物的使用, 防止多重耐药鲍曼不动杆菌传播, 而本研究只检测了5种金属酶基因型中以IMP、VIM 为主的2种, 也可能存在其他3种基因型及其他亚型, 这都还有待进一步试验研究。通过对仁济医院近年来的细菌耐药性分析, 发现近年来头孢类和碳青霉烯类耐药率有较大幅度提高, 特别是碳青霉烯类耐药率上升极为迅速:2003年仁济医院鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别为4.6%和2.9% [15]。本研究结果显示, 2010年仁济医院东院鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别达到了69.5%和71.6%, 碳青霉烯类耐药率的大幅度提高, 给临床治疗带来了很大的困难。本研究通过调查浦东与浦西不同医院之间的鲍曼不动杆菌耐药情况和基因型别, 表明上海不同地区鲍曼不动杆菌的流行型别有所不同, 可能与不同地区医院的抗菌药物使用情况有关, 具体流行型别尚需进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|