作者简介:王地英,女,1971年生,学士,主管技师,主要从事临床检验工作。
探讨免疫抑制法测定血清线粒体型天门冬氨酸氨基转移酶(m-AST)的影响因素。
方法应用免疫抑制法和酶水解法分别测定60例肝炎患者和48名肝功能基本正常者(AST≤50 U/L,对照组)的m-AST和天门冬氨酸氨基转移酶(AST),计算m-AST/AST比值;通过外加胞浆型天门冬氨酸氨基转移酶(c-AST)抗体试验,分析免疫抑制法试剂中存在的抗c-AST抗体不足问题。
结果对照组免疫抑制法m-AST测定结果明显高于酶水解法( P<0.01);肝炎组则明显低于酶水解法( P<0.01)。由免疫抑制法得出的m-AST/AST比值在对照组和肝炎组之间差异无统计学意义( P=0.094);由酶水解法得出的m-AST/AST比值肝炎组明显高于对照组( P<0.01)。肝炎组免疫抑制法m-AST和AST的相关性( r=0.969)高于对照组( r=0.878);而酶水解法二者的相关性( r=0.856)则低于对照组( r=0.902)。在免疫抑制法外加抗c-AST抗体试验中,m-AST测定值随抗c-AST抗体加入量的增加而下降。
结论免疫抑制法试剂中抗体不足导致c-AST抑制不完全,m-AST项目特异性下降。使用m-AST/AST比值可以分析肝病的严重程度。规范免疫抑制法m-AST试剂中的抗体浓度、抗体稳定剂等因素有利于质量控制工作,提高m-AST的临床应用价值。
To investigate the influence factors of determining serum mitochondrial aspartate aminotransferase (m-AST) by immune suppression method.
MethodsThe determinations of m-AST and aspartate aminotransferase (AST) in a control group (48 cases with AST ≤50 U/L) and a hepatitis group (60 patients with hepatitis) were performed by immune suppression method and enzyme hydrolysis method respectively, and then the m-AST/AST ratios were calculated. The deficiency of cytosolic aspartate aminotransferase (c-AST) antibody in the immune suppression method reagents was confirmed through the complementary c-AST antibody test.
ResultsIn the control group, the m-AST value by immune suppression method was significantly higher than that by enzyme hydrolysis method ( P<0.01), while in the hepatitis group, the m-AST value by immune suppression method was significantly lower than that by enzyme hydrolysis method ( P<0.01). By the immune suppression method, the m-AST/AST ratio had no significant difference between the control group and the hepatitis group ( P=0.094). By the enzyme hydrolysis method,the m-AST/AST ratio in the hepatitis group was significantly higher than that in the control group ( P<0.01). The correlation of m-AST and AST in the hepatitis group ( r=0.969) was higher than that in the control group by immune suppression method ( r=0.878), while by the enzyme hydrolysis method, the correlation in the hepatitis group ( r=0.856) was lower than that in the control group ( r=0.902). In the complementary c-AST antibody test of immune suppression method, the values of m-AST decreased with the increase of c-AST antibody being added.
ConclusionsIf the c-AST antibody is not enough in the immune suppression method reagents, c-AST could not be inhibited completely, which would cause the decline of the specificity of m-AST test. Using the m-AST/AST ratio,the severity of the liver disease can be analyzed. The antibody concentration of m-AST reagent, the antibody stabilizers and so on should be standardized in order to contribute to the quality control work and improve the clinical application significance of m-AST.
天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)广泛存在于人体各组织细胞中, 尤其以肝脏细胞、心肌细胞含量最为丰富, 所以AST常用于肝脏疾病和心肌疾病的检测。电泳分析法进一步将AST分为胞浆型AST (cytosolic AST, c-AST)和线粒体型AST(mitochondrial AST, m-AST)[1, 2]。血清中AST的活性为c-AST和m-AST的活性之和。AST、m-AST、c-AST三者密切相关。正常机体或机体轻度病变时, 部分机体细胞的细胞膜渗透性增高, c-AST逸出到细胞外液, 血清c-AST活性较高, 而m-AST活性较低。严重疾病时, 出现细胞坏死、线粒体崩解, 大量m-AST从坏死细胞逸出导致血清m-AST活性增高。急性肝炎、重症肝炎血清c-AST增高的同时, 也伴随m-AST活性的增高。因此, m-AST测定有利于急性肝炎、重症肝炎的早期诊断[3, 4]。m-AST的检测方法目前主要有免疫抑制法和酶水解法2种, 但2种方法的测定结果存在差异。因此有必要通过同组样本2种方法测定m-AST的比较及外加c-AST抗体试验分析免疫抑制法测定m-AST中存在的问题, 同时讨论m-AST/AST比值的临床应用。
选择苏州大学附属常州肿瘤医院2011年9至12月住院患者60例作为肝炎组, 男31例, 女29例, 均为急性肝炎、重症肝炎等存在肝细胞坏死的患者(AST≥ 200 U/L)。选择苏州大学附属常州肿瘤医院同期健康体检者48名作为对照组, 男23名, 女25名, 肝功能基本正常(AST≤ 50 U/L)。2组年龄基本匹配, 空腹静脉采血, 及时分离血清。
德国西门子Bayer公司 ADVIA 1200全自动生化分析仪。免疫抑制法m-AST试剂为上海YULAN生物公司产品(批号201104D0406), 标准品为冻干血清, 无定标溯源。酶水解法m-AST试剂为北京华宇亿康生物工程技术公司产品(批号120118), 标准品为电泳纯, m-AST/AST=1.22, 标准溯源为Original formulation IFCC2002。AST试剂为德国CENTRONIC公司(IFCC)产品(批号GF04101H66H)。
1.测定原理
免疫抑制法的原理是在羊抗人c-AST抗体作用下, 血清中的c-AST活性被抑制, 而m-AST活性不受影响, 用速率法测定m-AST活性。酶水解法采用专一性的c-AST水解剂特异性地水解血清中的c-AST, 同样用速率法测定血清中的m-AST活性。每份样本均测定AST并用免疫抑制法和酶水解法同时检测m-AST, 计算m-AST/AST比值。比较2种方法测定m-AST的差异及m-AST与AST的相关性。
2.免疫抑制法外加抗c-AST抗体试验
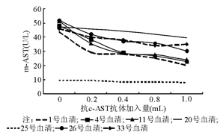
取免疫抑制法R1试剂5.0 mL, 分别加入抗c-AST抗体(效价1∶ 128, 由上海北加生物技术公司提供)0.0、0.2、0.4、0.8、1.0 mL, 配制成新的R1试剂后分别重新定标并测定样本, 观察m-AST测定值的变化。
统计分析采用SPSS 13.0统计软件包, 数据采用
对照组免疫抑制法m-AST测定结果明显高于酶水解法(P< 0.01); 肝炎组则明显低于酶水解法(P< 0.01)。由免疫抑制法得出的m-AST/AST比值在对照组和肝炎组之间无明显差异(P=0.094); 由酶水解法得出的m-AST/AST比值肝炎组明显高于对照组(P< 0.01)。肝炎组免疫抑制法m-AST和AST的相关性(r=0.969)高于对照组(r=0.878); 酶水解法二者的相关性(r=0.856)则低于对照组(r=0.902)。见表1。
| 表1 对照组与肝炎组m-AST、AST、m-AST/AST比值及相关性结果 |
m-AST主要来源于细胞内线粒体, 在正常人群血清只占18%左右, 血清AST活性主要来源于c-AST[5]。肝脏严重病变时, 肝细胞坏死, 线粒体崩解, 大量m-AST释放入血, 导致血清m-AST和AST活性增高, 同时m-AST/AST比值升高。本研究对照组免疫抑制法m-AST测定结果明显高于酶水解法(P< 0.01), 肝炎组则明显低于酶水解法(P< 0.01)。原因可能为抗c-AST抗体与c-AST结合后, 并未完全覆盖酶的活性中心, 不能完全抑制所有c-AST的活性; 另外, 可能还有少量抗体与m-AST产生交叉反应, 所以m-AST的最终测定结果=参与反应的m-AST+未被抑制的c-AST-被交叉抑制的m-AST。在m-AST含量较低时, 免疫抑制法测定m-AST的结果偏高; 在m-AST含量较高时, 免疫抑制法测定m-AST的结果偏低。另外, 免疫抑制法m-AST测定结果随AST升高而升高, 使肝炎组免疫抑制法m-AST和AST的相关性(r=0.969)明显高于酶水解法二者的相关性(r=0.856)。卢业成等[6]报道, m-AST/AST比值从高到低依次为重型肝炎(0.375± 0.073)、酒精性肝炎(0.311± 0.048)、慢性肝炎(0.307± 0.039)、急性肝炎(0.302± 0.046)、药物性肝炎(0.295± 0.030)、肝硬化(0.276± 0.049)。本研究酶水解法m-AST/AST比值肝炎组明显高于对照组(P< 0.01), 与卢业成等[6]报道的基本一致。而免疫抑制法m-AST/AST比值对照组和肝炎组无明显差异(P=0.094), 显示不出严重肝病时m-AST特异性增高的诊断价值。
本研究对照组基本不存在肝细胞坏死和线粒体崩解, 所以m-AST和m-AST/AST比值都应该较低。肝炎组因肝细胞病变, m-AST和m-AST/AST比值都应该较高, 并明显高于对照组。但本研究由免疫抑制法得出的m-AST/AST比值对照组高于肝炎组, 而酶水解法m-AST/AST比值则相反。这表明AST和m-AST升高时免疫抑制法m-AST的特异性下降, 原因可能在于抗c-AST抗体不足, c-AST的活性没有完全抑制。通过外加抗c-AST抗体试验充分说明了抗c-AST抗体不足的问题, 样本在额外加入抗c-AST抗体后, 测定值下降, 并与抗体加入量相关。抗c-AST抗体浓度是m-AST测定的主要影响因素之一, 试剂中抗体加入量及其储存过程中稳定性值得深入探讨。也有可能是抗c-AST抗体特异性较差, 抗体和c-AST结合后并未完全覆盖c-AST的活性中心, 导致c-AST不能完全被抑制, m-AST测定结果偏高。
对m-AST测定中m-AST/AST比值问题存在不同认识, 如果仅仅关注m-AST的测定值, 免疫抑制法中的抗体不足问题就不容易发现, 临床应用价值也就下降。如果以m-AST/AST比值作为关注对象, 比较容易发现免疫抑制法试剂中的抗体浓度及其稳定性等质量问题。本研究酶水解法m-AST/AST比值肝炎组高于对照组, m-AST/AST比值上升, 可以作为肝脏功能严重病变指标之一。
m-AST测定主要应用于肝脏疾病的诊断, 包括病毒性肝炎、酒精性肝损害、药物性肝炎、自身免疫性肝病等。病毒性肝炎m-AST升高机制已经比较清晰, Gane等[7]发现病毒性肝炎肝细胞线粒体的氧化应激导致线粒体受损, 进而肝细胞坏死, 线粒体崩解, m-AST大量进入血液。除肝脏外, m-AST还富含于肾脏、心脏、骨骼肌等多种组织及细胞中, m-AST测定有利于这些组织疾病的诊断及治疗。成人和儿童的线粒体功能障碍是神经变性疾病和神经肌肉疾病等多系统疾病的主要病因[8], m-AST活性改变成为诊断指标之一。m-AST也是器官移植的监测指标之一。
总之, m-AST测定具有较好的临床应用价值, 但必须在保证抗体浓度及其稳定性等试剂质量的前提下, 更多关注m-AST/AST比值, 才能充分发挥其应有的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|