作者简介:侯彦强,男,1971年生,博士,副主任技师,主要从事临床感染免疫基础及检验研究。
探讨血浆循环DNA(cf-DNA)水平定量检测在败血症诊断和败血症与全身炎症反应综合征(SIRS)鉴别诊断中的价值。
方法利用分支链DNA Alu技术定量检测24例败血症患者、43例SIRS患者和73名健康人血浆cf-DNA的表达水平;绘制受试者工作特征(ROC)曲线评估血浆cf-DNA的临床价值。
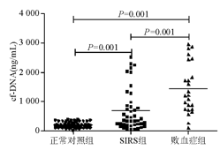
结果正常对照组血浆cf-DNA表达水平为68.56(12.56~309.78) ng/mL,SIRS组为609.67(15.98~2 596.87) ng/mL,败血症组为1 398.96(19.28~2 987.56) ng/mL,败血症组明显高于正常对照组( P<0.001)和SIRS组( P<0.001)。SIRS组与正常对照组、败血症组与正常对照组、败血症组与SIRS组的曲线下面积(AUC)分别为0.763 (0.661~0.865)、0.955 (0.884~1.025) 和0.777 (0.663~0.891)。
结论血浆cf-DNA具有作为新的败血症诊断标志物的临床应用价值。
To investigate the significance of plasma cell-free DNA (cf-DNA) in diagnosis of sepsis and differential diagnosis between sepsis and systemic inflammatory response syndrome (SIRS).
MethodsThe plasma cf-DNA of 24 sepsis patients, 43 SIRS patients and 73 healthy controls were detected by bDNA-based Alu quantitative assay. Receiver operating characteristic (ROC) curve was performed to evaluate the clinical significance of plasma cf-DNA.
ResultsThe plasma cf-DNA significantly increased in sepsis patients compared with in SIRS patients and healthy controls [1 398.96(19.28-2 987.56) ng/mL, 609.67(15.98-2 596.87) ng/mL and 68.56(12.56-309.78) ng/mL, respectively, P<0.001]. The areas under the ROC curve (AUC) of cf-DNA for the SIRS patients with healthy controls, sepsis patients with healthy controls and sepsis patients with SIRS patients were 0.763(0.661-0.865), 0.955 (0.884-1.025) and 0.777 (0.663-0.891), respectively.
ConclusionsPlasma cf-DNA has a clinical significance as a new biomarker for the diagnosis of sepsis.
败血症(sepsis)是一类因多种病原菌进入机体血液系统后迅速繁殖、产生大量毒素, 机体受激发产生过度的炎症反应。目前败血症是重症监护病房(ICU)患者死亡的一个重要原因, 据统计, 在西方发达国家每年大约有150万人患病, 死亡率高达30%~50%[1, 2]。败血症死亡率高的主要原因之一是因为缺少理想的实验诊断指标, 早期诊断困难, 阻碍了早期有效的抗菌药物治疗。血液培养病原菌是目前诊断败血症的“ 金标准” , 但此方法检测时间长, 对血液样本要求较高, 阴性结果并不能完全排除败血症感染[3]。循环DNA(cell-free DNA, cf-DNA)是存在于血液(血浆或血清)、滑膜液、脑脊液等体液中的细胞外DNA, 近年研究发现, cf-DNA在正常人中含量很少, 但在炎症、肿瘤和自身免疫性疾病中表达升高[4, 5]。实时荧光定量聚合酶链反应(PCR)是目前最常用的cf-DNA检测方法, 但该方法存在样本要求高、操作复杂、技术要求高等缺陷和不确定性因素。本研究以人基因中最丰富的重复序列Alu为靶基因, 采用先进的分支链DNA技术定量检测血浆cf-DNA在败血症患者中的表达, 探讨血浆cf-DNA在败血症中的临床应用价值。
选取上海交通大学附属第一人民医院松江分院2009年1月至2011年6月ICU住院的败血症患者24例, 其中男15例, 女9例, 年龄(58.3± 12.7)岁, 病因主要为手术、肠梗阻、肠穿孔等。24例患者中, 血培养结果病原菌感染革兰阴性菌阳性13例(大肠埃希菌8例, 肺炎克雷伯菌3例, 铜绿假单胞菌2例), 血培养革兰阳性菌阳性8例(金黄色葡萄球菌5例, 表皮葡萄球菌3例), 真菌感染3例(白念珠菌2例, 克柔假丝酵母1例)。另选取43例全身炎症反应综合征(SIRS)患者和73名健康人作对照组。SIRS患者均未发生器官功能障碍且均非由感染引起, 男26例, 女17例, 年龄(55± 11)岁。正常对照组中男45名, 女28名, 年龄(53± 13)岁。以上病例均在使用抗菌药物治疗前采集样本。
基因定量试剂盒(QuantiGene 2.0 Assay kit)购于Affymetrix公司; PE VicTor3 V酶标仪购自美国PerkinElmer公司; SHELLAB孵育箱购于美国SHELLAB公司。
采集空腹静脉血3 mL, 用乙二胺四乙酸(EDTA)抗凝, 3 000× g离心10 min, 吸取上清于1.5 mL微量离心管中16 000× g离心10 min, 吸取血浆层, -80 ℃保存备用。
采用分支链DNA Alu技术检测血浆cf-DNA, 严格按照试剂盒操作步骤进行检测, 简要步骤如下:(1) DNA标准品和待测样本准备。人DNA标准品1∶ 1对比稀释, 终浓度为100、50、25、12.5、6.25、3.125、1.56、0 ng/mL; 将待测样本用双蒸水稀释20倍, 190 μ L双蒸水加入10 μ L待测血浆; 将标准品、样本100 ℃加热5 min后, 立即置于冰水中冷却备用; (2) 加20 μ L处理后的标准品、样本和80 μ L工作液(包含裂解液、人Alu的CE、LE探针、封闭液、蛋白酶K等)(Panomics, SantaClara, CA)于预包被人寡核苷酸捕获探针的96孔板中, 55 ℃孵育12~18 h, 洗液(0.1× 含有0.3 g/L柠檬酸锂十二烷基硫酸盐的标准盐水)洗涤3次; (3) 加入100 μ L前置放大分子(pre-amplifier)工作液(Panomics, SantaClara, CA), 55 ℃孵育1 h, 洗液洗涤3次; (4) 加入100 μ L放大分子(amplifier)工作液(Panomics, SantaClara, CA), 55 ℃孵育1 h, 洗液洗涤3次; (5) 加入100 μ L 3'端连接碱性磷酸酶的标记探针(label probe)工作液(Panomics, SantaClara, CA), 55 ℃孵育1 h, 洗液洗涤3次; (6) 加入100 μ L碱性磷酸酶底物(Panomics, SantaClara, CA), 室温反应 5 min; (7) Perkin Elmer Victor3 V酶标仪上检测分析。
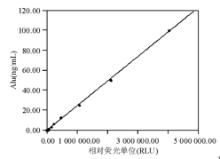
使用美国Promega公司的人基因组DNA来评价该方法的准确性、线性范围以及最低检出值。结果显示在0~400 ng/mL DNA浓度范围内, 回归线性方程为Y=1 778.9X, r2=0.992。最低检出限为0.86 ng/mL。准确性达93.35%~115.76%。
使用SPSS 13.0软件进行数据分析。数据用中位数(范围)表示, 采用非参数Mann-Whitney方法比较2组间差异; 采用受试者工作特征(ROC)曲线的曲线下面积(AUC)分析评估血浆cf-DNA对败血症的诊断及与SIRS的鉴别诊断价值。P< 0.05为差异有统计学意义。
利用人DNA标准品绘制cf-DNA标准曲线, 从100 ng/mL 1∶ 1对比稀释人DNA标准品, 结果显示相关系数r2为0.999 1, 线性方程Y=2× 10-5X-0.031 2, 见图1。正常对照组血浆cf-DNA表达水平为68.56(12.56~309.78) ng/mL, SIRS组为609.67(15.98~2 596.87) ng/mL, 败血症组为1 398.96(19.28~2 987.56) ng/mL。败血症组血浆cf-DNA表达水平明显高于正常对照组和SIRS组(P< 0.001); SIRS组明显高于正常对照组(P< 0.001), 见图2。
绘制ROC曲线评估血浆cf-DNA的临床价值。SIRS组与正常对照组、败血症组与正常对照组、败血症组与SIRS组的AUC分别为0.763(0.661~0.865)、0.955(0.884~1.025)和0.777(0.663~0.891)。血浆cf-DNA诊断败血症的最佳临界值为385 ng/mL, 敏感性为91.7%, 特异性为98.6%。血浆cf-DNA鉴别诊断败血症和SIRS的最佳临界值为522 ng/mL, 敏感性为91.7%, 特异性为60.5%。见图3。
败血症是由感染引起的全身炎症反应, 其临床症状是非特异性的, 与SIRS十分相似, 由于缺少理想的实验诊断指标, 败血症诊断及鉴别诊断困难, 容易延误治疗, 造成死亡率一直居高不下。目前临床用于诊断败血症的实验室指标主要包括C反应蛋白(CRP)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子α (TNF-α )和降钙素原(PCT)等, 但因在诊断的特异性和敏感性方面存在不足, 这些指标都不是理想的诊断标志物[6, 7, 8]。PCT被认为是目前最好的败血症实验室诊断标志物, 但其在败血症诊断、预后及与SIRS的鉴别诊断方面的价值并不十分理想[9, 10, 11], 最近有研究者利用meta分析, 统计分析了18篇PCT作为败血症实验诊断标志物的论文, PCT敏感性和特异性的平均值均只有71%[95%可信区间(CI) 67~76], AUC为0.78(95% CI 0.73~0.83)[12]。Pierrakos等[13]对3 370篇文献中的178个败血症诊断标志物进行分析, 也得出了类似的结论, 认为PCT在败血症的鉴别诊断和预后方面存在不足。因此, 急需寻找新的败血症标志物。
分支链DNA技术是一种不依赖PCR扩增的核酸杂交信号放大检测技术, 该技术克服了传统的实时PCR技术中的缺陷与不确定因素, 无需抽提纯化RNA, 无需反转录, 无需PCR扩增, 只要将样本用特定裂解液裂解后, 经探针杂交与信号放大后即可迅速得到基因定量结果[14]。在人类的基因组中有一种中等重复序列, 长约300 bp, 30万个成员分散分布在单倍体基因组中, 在其170 bp处有一个限制性酶AluI的酶切位点, 故称这个重复序列为Alu基因家族(Alu family), 大约平均每隔6 kb左右就有1个Alu序列, 在哺乳动物体内含量最丰富, 同源性最高, 因此其可作为人类DNA片段的特异标记。本研究中, 我们以Alu为靶基因, 利用分支链DNA技术检测循环DNA的表达。本研究结果显示, 败血症患者血浆cf-DNA水平明显高于SIRS患者和正常人(P< 0.001), ROC曲线分析发现, 血浆cf-DNA指标对败血症具有较高诊断价值(AUC=0.955), 当最佳临界值为385 ng/mL时, 敏感性为91.7%, 特异性为98.6%; 对于败血症与SIRS的鉴别诊断, 血浆cf-DNA指标同样表现出较高的应用价值, AUC为0.777, 最佳临界值为522 ng/mL, 敏感性为91.7%, 特异性为60.5%。
关于cf-DNA的确切来源尚未阐明, 目前主要有2种观点:一是认为细胞凋亡或坏死时细胞释放DNA至外周血中; 二是细胞主动分泌释放DNA到外周血, 如肿瘤细胞[15]。近来有研究发现, cf-DNA的水平与肿瘤细胞数量并不一致, 说明cf-DNA不仅来自于肿瘤细胞, 其他细胞在应激条件下也可能分泌cf-DNA[16]。对于败血症循环DNA升高的机制, 主要应该是败血症导致大量细胞凋亡、坏死所致, 因为近年来大量研究证实, 凋亡在败血症的发病机制中起到重要作用, 凋亡使免疫细胞和非免疫细胞功能缺失, 进而导致免疫抑制和多器官功能衰竭[17, 18]。
综上所述, 本研究利用先进的分支链DNA Alu技术研究发现, 血浆cf-DNA在败血症的诊断和鉴别诊断中表现出较高的应用价值, 具有作为新的败血症诊断标志物或辅助指标的临床价值, 有待于进一步深入研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|