作者简介:陈旭,男, 1988年生,学士,主要从事微生物学研究。
通讯作者:韩立中,联系电话:021-64370045-600632。
评价实时荧光定量聚合酶链反应(PCR)在快速检测耐甲氧西林金黄色葡萄球菌(MRSA)中的应用。
方法采用头孢西丁纸片扩散法和 mecA基因PCR检测法,将85株临床分离的金黄色葡萄球菌区分为MRSA和甲氧西林敏感金黄色葡萄球菌(MSSA),并采用实时荧光定量PCR对这些菌株进行检测,评价MRSA检测中实时荧光定量PCR与目前常规检测方法的一致性。
结果根据头孢西丁纸片扩散法和 mecA基因扩增结果进行分组,85株金黄色葡萄球菌中MRSA组菌株45株, MSSA组菌株40株;实时荧光定量PCR检测结果与上述结果完全一致,符合率为100%。
结论实时荧光定量PCR检测MRSA的结果与常规方法一致性好,且具有操作简便、耗时短等特点。作为一种快速检测方法,实时荧光定量PCR能将金黄色葡萄球菌的鉴定和MRSA的筛选结合起来,对于指导临床用药及MRSA医院感染控制具有重要意义。
To evaluate the application significance of the real-time fluorescence quantitative polymerase chain reaction (PCR) in the rapid identification of methicillin-resistant Staphylococcus aureus (MRSA).
MethodsA total of 85 Staphylococcus aureus strains were isolated from clinical samples, and MRSA and methicillin-sensitive Staphylococcus aureus (MSSA) were detected and differentiated by cefoxitin disk diffusion method and conventional PCR amplification of mecA gene. These strains were also detected by the real-time fluorescence quantitative PCR. The accordance of the real-time fluorescence quantitative PCR with conventional methods was evaluated.
ResultsAccording to the results of the cefoxitin disk diffusion method and conventional PCR amplification of mecA gene, 45 out of 85 strains were MRSA, and 40 out of 85 strains were MSSA. The real-time fluorescence quantitative PCR had an excellent accordance (100%) with those methods.
ConclusionsThe real-time fluorescence quantitative PCR has an excellent accordance with conventional methods for detecting MRSA, and it has the advantages of ease of performance and costing short turn-around time. As a rapid identification method, the real-time fluorescence quantitative PCR can identify MRSA accurately, which is helpful for the clinical therapy of MRSA infections and for the control of MRSA transmission in hospitals.
金黄色葡萄球菌(Staphylococcus aureus)是医院感染和社区感染的重要病原体之一[1, 2, 3], 耐甲氧西林金黄色葡萄球菌(MRSA)的出现使得治疗金黄色葡萄球菌感染更加困难。MRSA主要耐药机制为细菌染色体mecA基因编码对β -内酰胺类抗菌药物低亲和力的青霉素结合蛋白(PBP2a)[4], 从而使MRSA对所有β -内酰胺类抗菌药物具有耐药性。根据2011年美国临床实验室标准化协会(CLSI)推荐, 可通过mecA基因的检测确认MRSA。近年来, 国内外学者积极致力于研究实时荧光定量聚合酶链反应(PCR)用于金黄色葡萄球菌或MRSA的鉴定与分型技术[5, 6], 实时荧光定量PCR能将金黄色葡萄球菌的鉴定和MRSA的筛选结合起来, 对金黄色葡萄球菌或MRSA进行快速检测, 与普通PCR相比具有操作简便、耗时短、污染小、易于临床应用等特点。本研究对85株金黄色葡萄球菌同时使用实时荧光定量PCR和常规检测方法进行MRSA检测, 分析实验方法的一致性, 以对实时荧光定量PCR在MRSA的检测能力进行评估。
收集2009年1至12月临床分离的85株金黄色葡萄球菌, 均分离自烧伤创面且为非重复菌株。标准参考菌株为金黄色葡萄球菌(ATCC 25923)。
DNA酶琼脂(上海源叶生物科技有限公司); 甘露醇高盐琼脂(上海源叶生物科技有限公司); 鸟氨酸脱羧酶试验培养基和对照培养基(上海市疾病预防控制中心); 水解酪蛋白胨(MH)培养基(法国生物梅里埃公司); 头孢西丁(30 μ g)纸片(英国Oxoid公司); 普通PCR仪(Bio-Rad); SLAN荧光定量PCR仪和MRSA检测试剂盒(上海之江生物有限公司); mecA基因检测引物(上游引物:5'-TCCAGATTACAACTTCACCAGG-3'; 下游引物:5'-CCACTTCATATCTTGTAACG-3')由上海生工生物有限公司合成。
1.菌株鉴定
菌株根据菌落特征、镜下形态、触酶试验及其他一系列表型试验如DNA酶试验、高盐甘露醇试验、血浆凝固酶和鸟氨酸脱羧酶试验等[7]将待检菌株鉴定为金黄色葡萄球菌。
2.MRSA与甲氧西林敏感金黄色葡萄球菌(MSSA)的分组
根据2011年CLSI标准[8], 采用头孢西丁纸片扩散法筛选MRSA。判别标准为:抑菌圈直径≥ 22 mm为敏感, ≤ 21 mm为耐药。药物敏感性试验采用标准菌株金黄色葡萄球菌(ATCC 25923)进行质量控制。采用PCR扩增mecA基因进行MRSA确认, 采用简化碱裂解法提取细菌核酸作为PCR模板。25 μ L反应体系包括:10× PCR缓冲液 2.5 μ L, 镁离子(25 mmol/L)2.2 μ L, dNTP混合液(10 mmol/L)0.5 μ L, 上游引物和下游引物(10 μ mol/L)各1 μ L, Taq DNA聚合酶(5 U/μ L)0.1 μ L, 双蒸水15.7 μ L, 模板2 μ L。PCR扩增条件为:预变性94 ℃ 10 min; 变性94 ℃ 30 s, 退火55 ℃ 30 s, 延伸72 ℃ 1 min, 30个循环; 后延伸72 ℃ 10 min。PCR产物1%琼脂糖凝胶电泳, Tanon GIS成像系统拍摄。
3.实时荧光定量PCR快速检测MRSA
根据MRSA耐药基因检测试剂盒操作说明书进行操作。反应体系为40 μ L, 其中检测混合液35.6 μ L, 酶0.4 μ L, 模板4 μ L。每份标本包括2管, 1管用于检测金黄色葡萄球菌特异性核酸片段(耐热核酸酶基因nuc)从而对金黄色葡萄球菌进行鉴定, 1管用于检测耐药基因(mecA)从而对MRSA进行鉴定, Ct值≤ 35时检测结果为阳性, 判读标准见表1。
| 表1 SLAN荧光定量PCR仪快速检测MRSA结果判读标准 |
采用SPSS 16.0软件进行统计学分析, 一致性分析采用Kappa检验, P< 0.05为差异具有统计学意义。
根据头孢西丁纸片扩散法结果, 85株金黄色葡萄球菌中头孢西丁耐药45株, 敏感40株。PCR扩增mecA基因发现, 45株头孢西丁耐药的金黄色葡萄球菌mecA阳性, 40株头孢西丁敏感的金黄色葡萄球菌mecA阴性, 本研究收集的菌株中不存在非mecA介导的耐药菌株。
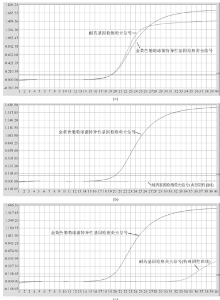
实时荧光定量PCR荧光扩增曲线与结果解释见图1。图1a为典型MRSA曲线, 金黄色葡萄球菌特异性基因阳性(Ct值为19.28, 荧光曲线为典型的“ S” 形), 耐药基因阳性(Ct值为19.35, 荧光曲线为典型的“ S” 形), 结果报告为MRSA。图1b为典型MSSA曲线, 金黄色葡萄球菌特异性基因阳性(Ct值为20.07, 荧光曲线为典型的“ S” 形), 耐药基因阴性(无Ct值, 荧光曲线为一条直线), 结果报告为MSSA。图1c为特殊的MSSA曲线, 金黄色葡萄球菌特异性基因阳性(Ct值为19.21, 荧光曲线为典型的“ S” 形), 耐药基因检测Ct值接近35.00, 但2种基因检测Ct值相差较大, 综合分析后报告为MSSA。
实时荧光定量PCR通过直接检测荧光信号形成荧光扩增曲线, 无需电泳。实时荧光定量PCR结果显示, 收集的85株菌株金黄色葡萄球菌特异性核酸片段均为阳性, 即鉴定为金黄色葡萄球菌, 与表型鉴定结果一致。通过比较发现在MRSA检测方面, 本方法与传统检测方法符合率为100%, 见表2。Kappa检验分析结果显示, Kappa值为1.0, 表明两者一致性较好。
| 表2 实时荧光定量PCR与mecA基因检测结果比较 |
近年来, 临床MRSA的分离率不断上升, 且由于其具有多重耐药性, 大部分抗菌药物对MRSA感染的治疗效果较差, 因此快速准确地检测出MRSA对指导临床正确用药具有重要意义。在医院感染控制方面, 如果在所有患者入院时就执行接触预防措施, 可有效减低医院获得性MRSA感染的机会, 但会给医院的床位供应和医疗资源增加负担, 也不易被患者接受。如果在获得 MRSA筛查结果后针对性采取接触预防措施, 则可减低费用并易于被患者接受, 但是在获得筛查结果前存在MRSA医院内传播的风险, 因此建立快速准确的MRSA检测方法对于有效降低医院感染率具有一定的重要性。此外, 国内外也相继有社区MRSA感染病例(社区获得性MRSA)的报道[9, 10, 11], 因此及时地检测出MRSA不仅有益于医院内MRSA感染的控制与预防[12], 也有利于预防和控制社区获得性MRSA在医院内传播。
MRSA的实验室检查方法包括基于培养的传统检测技术和分子检测技术[5, 6, 12], 标准培养方法通常要求48~72 h, 显色培养基和PCR检测可将报告时间明显缩短。头孢西丁纸片扩散法是CLSI推荐筛选MRSA表型的方法, 该方法与mecA基因符合性好, 准确性高, 成本低, 是目前临床微生物实验室筛选MRSA的重要方法, 但该方法需要得到纯化培养的细菌, 配制细菌悬液, 贴药物敏感性纸片后还需培养24 h才能量取结果, 操作较繁琐, 需要大量时间才能获得最终结果。采样后直接接种至显色培养基可以大大缩短检测时间, 此方法敏感性好, 菌落颜色特异性高, 但对培养基要求高, 也需要24~48 h。胶乳凝集法也是检测MRSA的一种有效方法, 该技术也要求得到纯化的菌株, 需提取mecA基因编码的产物PBP2a, 但对于低表达PBP2a的菌株会出现弱凝集反应或凝集延迟[13]。实时荧光定量PCR与常规PCR相比, 具有敏感性高、特异性强、污染少、自动化程度高等特点[14, 15]。为了准确迅速地对MRSA进行鉴定, 国内外学者建立了一系列分子技术[5, 6, 16, 17, 18, 19]。
本研究中实时荧光定量PCR快速检测法通过检测2种基因(金黄色葡萄球菌特异性核酸片段和耐药基因)的荧光信号来快速检测MRSA, 可以直接从临床标本中进行核酸提取, 标本类型包括鼻咽拭子、痰液、血液、分泌物等, 整个过程约2~3 h, 简便、快捷, 且准确性高。与传统的培养检测技术相比, 分子检测技术能够更快且准确地检测出MRSA, 与普通的PCR相比, 实时荧光定量PCR可以在PCR反应过程中直接检测荧光信号, 无需配胶、电泳等步骤, 可以更加快速有效地鉴别出MRSA, 且可以对靶位基因进行定量检测。在本研究中发现有部分菌株模板在通过SLAN荧光定量PCR仪扩增后, 金黄色葡萄球菌特异性核酸片段检测Ct值为20.00左右, 为典型的阳性, 但耐药基因检测Ct值在33.00~35.00之间, 2种基因检测Ct值相差较大(> 10.00以上), 见图1c, 若参照MRSA检测试剂盒操作说明书判读标准Ct值≤ 35.00为阳性, 即可能误判为MRSA, 造成假阳性, 因此在后期临床标本检测时应注意联合两者检测Ct值综合分析, 以避免造成假阳性。另外在本研究中实时荧光定量PCR是采用纯化的菌株提取模板, 后期直接采样提取核酸进行检测时需进一步临床观察是否与其他细菌有交叉反应, 需要对临床菌株收集、分型, 需要具体药物敏感性试验结果, 还需同时采样进行培养。
实时荧光定量PCR检测MRSA的结果与常规方法一致性较好, 且具有操作简便、耗时短等特点。作为一种快速检测方法, 实时荧光定量PCR能将金黄色葡萄球菌的鉴定和MRSA的筛选结合起来, 对于指导临床用药及MRSA医院感染控制具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|