作者简介:乔昀,女,1971年生,学士,副主任技师,主要从事微生物学检验工作。
通讯作者:张珏,联系电话: 021-53827187。
分析医院不同科室来源的耐甲氧西林金黄色葡萄球菌(MRSA)菌株基因分型同源性,为控制MRSA医院感染流行提供科学依据。
方法使用细菌基因组重复序列聚合酶链反应(REP-PCR)以及高级微生物基因分型系统(DiversiLab)细菌同源性分析技术对23株医院感染的MRSA进行基因分型。
结果23株MRSA分为4个基因型,A型、D型主要分布于急诊观察室,B型、C型主要分布于中医外科。
结论中医外科存在以B型、C型基因型为流行株的MRSA医院感染爆发;REP-PCR技术和DiversiLab自动化细菌同源性分型技术可成为医院感染病原研究的有效手段。
To provide scientific reference for controlling hospital acquired infection through analyzing the genotype homology of methicillin-resistant Staphylococcus aureus (MRSA) which were isolated from different departments of hospital.
MethodsThe genotypes of 23 strains of hospital acquired MRSA were analyzed by repetitive polymerase chain reaction (REP-PCR) and DiversiLab genotype system.
ResultsHospital acquired MRSA were classified into 4 kinds of genotypes(A,B,C and D).A and D types were mainly distributed in Emergency Observation Room, while B and C types were mainly distributed in Traditional Chinese Medicine Surgery Department.
ConclusionsB and C types may cause infection outbreak in Traditional Chinese Medicine Surgery Department as epidemic strains. REP-PCR and DiversiLab genotype system can be efficient ways for research of pathogen on nosocomial infection.
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococus aureus, MRSA)是医院感染的主要致病菌之一, 1961年便在英国发现了世界首例MRSA。目前在许多国家MRSA的感染率仍在上升。由于MRSA具有传播途径广、致病性强的特点, 加上抗菌药物的长期使用和滥用, MRSA的耐药范围日益扩大, 耐药程度日益严重, 给临床治疗带来巨大的困难, 也有人将其称为“ 超级细菌” 。为了解医院不同科室来源的MRSA菌株基因的同源性, 本研究对2011年2至6月医院临床分离的23株MRSA菌株应用Agilent2100分析仪的高级微生物基因分型系统(DiversiLab)对其结果进行分析, 以追踪传染源和可能的传播途径, 为采取有效措施预防和控制医院感染的发生提供科学依据。
1.标本来源
收集2011年2至6月上海中医药大学附属曙光医院重症监护室(ICU)、急诊观察室、中医外科入院48 h后患者送检的各类临床标本(标本送检离入院时间> 48 h为医院感染), 剔除重复菌株后共分离到23株MRSA, 其中急诊观察室6株, 中医外科13株, ICU 4株。标本类型包括脓液12株、痰4株、尿2株、分泌物2株、咽拭子2株、血液1株。
2.仪器和试剂
法国生物梅里埃公司的VITEK 2 Compact 微生物鉴定药敏分析系统、Agilent2100分析仪、自动化DiversiLab 微生物DNA指纹图谱分析系统及其UltraCleanTM微生物DNA分离试剂盒、DiversiLab DNA指纹图谱试剂盒、芯片试剂盒。血平板由上海伊华生物技术有限公司生产。
3.标准菌株
金黄色葡萄球菌(ATCC 25923)、金黄色葡萄球菌(ATCC 29213)由上海市临床检验中心提供。
1.细菌鉴定
标本送实验室后及时接种于血琼脂培养基上, 经35 ℃培养24 h。金黄色葡萄球菌用法国生物梅里埃公司的VITEK 2 Compact 仪VITEK GP板条进行鉴定。按美国临床实验室标准化协会(CLSI)标准[1]操作, 将0.5麦氏单位金黄色葡萄球菌的新鲜菌悬液均匀涂布于水解酪蛋白胨(MH)平板, 贴上头孢西丁(30 μ g)纸片, 35 ℃有氧环境孵育24 h观察结果, 测量抑菌圈直径。金黄色葡萄球菌抑菌圈直径≤ 19 mm为耐药, 即MRSA。
2.基因组重复序列聚合酶链反应(REP-PCR)操作程序
按照DiversiLab自动化分型系统要求操作, 细菌在琼脂平皿上培养过夜, 用10 μ L接种环取细菌1环 , 用DNA提取试剂盒提取细菌基因组DNA。DNA浓度使用分光光度计定量, 模板浓度要求在25~50 ng/μ L 之间。提取的DNA置-20 ℃备用。REP-PCR 体系为25 μ L, 其中重复序列PCR MM1 18 μ L, 引物混合物 2 μ L, 10× PCR 缓冲液和AmpliTaq DNA 聚合酶分别为2.5和0.5 μ L, 基因组DNA模板2 μ L。REP-PCR参数为:预变性94 ℃ 2 min; 变性94 ℃ 30 s; 退火45 ℃ 30 s; 延伸70 ℃ 90 s, 共35个循环, 最后延伸70 ℃ 3 min。将PCR 产物加载到微流芯片, 通过Agilent生物分析仪进行电泳, 探测产物的荧光强度, 绘制电泳片段峰式坐标图和模拟的胶样指纹图。用DiversiLab分析软件对结果进行阅读和分析。树状图在树状结构上显示指纹图谱相似度, 从而帮助可视化显示标本的分类情况。相似度矩阵提供了报告中每对标本间的相似度百分比, 阐明树状图中所见的平均化结果。
3.同源性判断标准
计算标本间相似度方法采用Pearson 相关系数(PC), 这种方法强调峰强超过峰的存在情况, 当图谱之间差异显著, 而在高强度峰的数量及位置方面尤其明显时, 则选择 PC 选项。根据MRSA遗传学高度相似性的特征, 将聚类结果的Cut off值选择在95%。菌株间相似性> 97%且胶样图无条带差别的菌株认定为相同; 相似性> 95%, 有1条条带不同判定为相似; 相似性< 95%, 有2 条及2条以上条带不同就认定为不同菌株[2, 3, 4]。按照DiversiLab自动化分型系统操作要求, 胶样图有疑问的菌株应追溯该菌的峰式坐标图, 此坐标图的比较结果是菌株间同源性的最终结果。
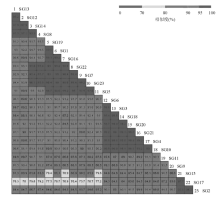
23株MRSA分别分离自ICU 、急诊观察室和中医外科。编号为SG 1、2、7、14菌株分离自ICU(共4株), SG3~6、SG9~10、SG16、SG18~23菌株分离自中医外科(共13株), SG8、SG11~13、SG15、SG17菌株分离自急诊观察室(共6株)。DiversiLab分型系统将本次研究的23株MRSA分为4型。A型菌株为SG12、13、14、8, 主要分布于急诊观察室; B型菌株为SG1、5、7、16、19、22、23, 主要分布于中医外科; C型菌株为SG3、4、6、10、18、20、21, 全部分布于中医外科; D型菌株为SG2、15、17, 主要分布于急诊观察室。见图1。
采用REP-PCR对遍布于细菌基因组中的非编码重复序列进行扩增, 从而产生各种片段大小不同的扩增产物, 扩增的片段在DNA芯片装置下由微流体分开, 荧光吸收检测后DiversiLab系统收集并分析数据, 同时产生相应的峰值图, 不同峰值代表不同大小DNA片段, 峰的位置、数目、峰高等特征判断菌株的同源性, 如果峰的位置、数目和峰高都一致, 两者的电泳图形可以重叠, 则认为是同一克隆, 划分为同一组; 有1条条带不同或峰的位置不同, 则认为2株菌相似。本次研究中DiversiLab 分析软件的分析结果做同源性树状图, 见图1。根据树状图菌株间相似性> 95%可判断菌株是相同或相似, 可将23株MRSA分为4种基因型。相似度高(> 97%)可认为来源于同一克隆[2, 3, 4]。菌株间相似度的百分比见图2。如SG8和SG13的相似度为97.3%。
医院感染MRSA几乎都是通过身体接触传播的, 多发生于具有严重基础疾病、年老体弱、静脉药物依赖、经常使用抗菌药物等高危因素的住院患者。MRSA引起的感染在全球范围内具有很高的发病率和病死率。近年来, MRSA的感染率和耐药率逐渐上升, 且很容易通过交叉感染在医院内爆发流行, 给临床抗感染治疗带来挑战。本研究应用DiversiLab自动化REP-PCR分型系统对2011年2至6月医院感染的MRSA进行分子流行病学分型研究, 分析其在医院的分布情况及可能的传播途径。
曙光医院23株MRSA分为4种基因型, 同一科室分离的菌株间有一定的同源性。中医外科13株中主要有2种基因型, B型5株、C型7株、1株散在, 急诊观察室6株中主要是A型3株、D型2株、1株散在; ICU 4株MRSA有3种基因型, A型1株、B型2株、C型1株, 说明流行株有病区差异。本研究中中医外科5株B型的MRSA全发生在入院后2个月(5~6月份)内, 7株C型的MRSA全发生在入院后3个月(3~5月份)内。在医院感染病例流行强度监测中, 由单一菌株在3 个月内同一病区引起≥ 3例MRSA医院感染定义为爆发[5] 。可见中医外科存在以B型、C型基因型为流行株的MRSA医院感染爆发。急诊观察室6株MRSA有2种基因型但发生的时间超过3个月, 不属于医院感染爆发。ICU有各科转至的危重患者, 4株MRSA有3种基因型, 包括了中医外科流行的B型、C型以及急诊观察室流行的A型。在急诊观察室获得MRSA感染的患者, 因病情严重转入ICU 后引起ICU 的继发病例, 后者病情好转后转入普通病房, 再引起普通病房的继发病例, 这就造成科室间MRSA的传播。已经明确MRSA的医院感染主要经接触传播, 医护人员及患者的手和鼻咽是重要的传播中介, 加强洗手和隔离等卫生预防学措施可以有效地降低MRSA的感染率[6]。
目前应用于MRSA 分子分型研究的技术主要有多位点序列分型(multilocus sequence typing, MLST) 、脉冲场凝胶电泳(pulsed field gel electrophoresis, PFGE)、扩增片段长度多态性(amplified fragment length polymorphism, AFLP)、葡萄球菌蛋白A基因分型(Staphylococcal protein A gene typing, SPA typing)和REP-PCR[7, 8]等。其中, PFGE分型技术被称为细菌分子分型的“ 金标准” 。但PFGE技术步骤复杂, 对人员和设备要求较高, 操作时间长, 不适宜作为临床实验室广泛采用的研究手段。REP-PCR 分型技术原理清晰, 重复性好, 但因手工操作非常耗时、成本贵等原因而未能广泛开展[9]。DiversiLab 是基于染色体REP-PCR的同源性分析方法, 是近年来继质粒谱分析、脉冲场电泳、探针杂交等分子生物学分型方法之后发展起来的又一基因分型技术。DiversiLab 分析系统是一种标准化和自动化系统, 其结果收集和分析处理不受主观限制, 60 min就可以分析13份标本, 其通过计算机系统对微生物DNA指纹图谱比对、分析, 进行微生物的基因分型及鉴定, 具有很高的分辨率。其结果既可以以凝胶图谱输出, 也可以以荧光强度为纵坐标、相对分子质量大小为横坐标的坐标图形式输出, 输出结果量化, 不同批次和时段输出也可进行比较。树状图在树状结构上显示指纹图谱相似度, 从而帮助可视化显示标本的分类情况。相似度矩阵提供了报告中每对标本间的相似度百分比, 阐明树状图中所见的平均化结果。与传统PFGE 相比, 具有很好的相关性, 且其具有快速、易于操作、高重复性、高分辨率、结果的定量处理和多种形式输出等优点, 可以作为分型鉴定的一线工具, 尤其对短期内爆发流行时大量标本检测具有更大优势, 同时作为各医院常规鉴定和分型研究也具有很好的意义[10]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|