作者简介:张成磊,男,1984年生,学士,主要从事临床检验诊断学研究。
通讯作者:杨宝珍,联系电话:0951-6746955。
研究负载相关抗原的树突状细胞(DC)联合细胞因子诱导的杀伤(CIK)细胞对胃癌细胞的杀伤作用。
方法取健康人外周血并分离出外周血单个核细胞(PBMC),经不同细胞因子分别诱导出DC和CIK细胞,热休克方法处理胃癌MKN-28细胞株并制备肿瘤抗原用于负载DC,与CIK细胞共培养,以流式细胞术检测DC、CIK细胞表型,MTS法检测CIK细胞对MKN-28细胞的杀伤作用。
结果CIK与DC共培养后,与单纯CIK细胞相比较,增殖活性明显提高,CD3+CD8+、CD3+CD56+双阳性细胞数增多并且具有更强的杀瘤活性,效靶比为20.0 ∶1时,负载MKN-28抗原的DC-CIK(Ag-DC-CIK)组对MKN-28的杀伤活性为(57.96±2.23)%,远大于未负载MKN-28抗原的DC-CIK组[(38.02±2.06)%]和单纯CIK组[(29.78±1.84)%],差异具有统计学意义( P<0.05)。
结论以热休克凋亡肿瘤细胞抗原负载的DC能促进CIK细胞增殖分化,并提高其对胃癌细胞的杀伤活性。
To study the killing effect of dendritic cells (DC) and cytokine-induced killer (CIK) cells pulsed with specific antigens against gastric cancer cells.
MethodsPeripheral blood mononuclear cells(PBMC)were isolated from healthy subjects. DC and CIK cells were induced by different cytokines. Gastric cell line MKN-28 lysates of heat shock were used as antigen and pulsed DC, which co-cultured with CIK cells. The phenotypes of DC and CIK cell membranes were determined by flow cytometry, and the killing activity of CIK against MKN-28 was determined by (MTS).
ResultsCompared with CIK, the co-cultured DC-CIK presented a significantly higher proliferation. The numbers of CD3+CD8+ and CD3+CD56+ cells increased, and the killing effect was enhanced. The cytotoxic activity to MKN-28 of DC-CIK pulsed with MKN-28 antigen(Ag-DC-CIK) group was (57.96±2.23)% , which was more strong than(38.02±2.06)% of DC-CIK pulsed without MKN-28 antigen group and(29.78±1.84)% of CIK group, respectively [the ratio of effect to target =20.0∶1].
ConclusionsHeat shock tumor-lysate-pulsed DC can strengthen the proliferation and killing activity of CIK against gastric cancer cells.
细胞因子诱导的杀伤 (cytokine-induced killer, CIK)细胞是存在于人体肝脏及血液中的, 经特定的细胞因子诱导后产生的一类对多种肿瘤细胞具有杀伤活性的细胞毒性T细胞。树突状细胞(dendritic cell, DC)是目前所知的功能最强大的抗原呈递细胞, 分布于身体绝大部分组织器官, 其摄取处理抗原, 刺激初始型T细胞活化, 从而参与机体免疫应答。热休克法可在较短时间内迅速提升肿瘤细胞内多种热休克蛋白(HSP)水平, 具有简捷、高效及保持目的蛋白天然活性的特点, 且HSP是天然免疫佐剂, 可增强抗原免疫反应性。本研究从健康人外周血中分离、培养DC和CIK细胞, 采用热休克法处理胃癌细胞制备抗原用于负载DC, 并与CIK细胞共培养, 观察CIK细胞增殖活性和表型的变化以及对胃癌MKN-28细胞株的杀伤作用。
RPMI-1640培养液、杜氏磷酸盐缓冲液(D-PBS)购自Gibco公司, 胎牛血清(FBS)购自HyClone公司, 胰蛋白酶-乙二胺四乙酸(EDTA, 0.25%)由Solarbio生产, 人淋巴细胞分离液(Ficoll)为TBS产品, 细胞因子重组人白细胞介素4(rhIL-4)、重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、肿瘤坏死因子 (TNF- α )购自厦门特宝生物工程股份有限公司, CD3单克隆抗体(CD3McAb)购自深圳达科为生物有限公司, 重组人白细胞介素2(rhIL-2)购自上海华新生物高技术有限公司, CellTiter 96 AQueous One Solution Cell Proliferation Assay试剂盒为Promega产品, 流式细胞仪标记抗体CD3、CD8、CD56、CD83、CD86等为美国Becton Dickinson公司产品, 人胃癌细胞株(MKN-28)由宁夏医科大学总医院肿瘤内科馈赠。
1. CIK细胞培养
取健康成年人肝素抗凝外周血50 mL, 加于等量人淋巴细胞分离液上, 分离出外周血单个核细胞(PBMC), RPMI-1640培养液调细胞浓度为(4~6)× 106/mL, 置于37 ℃ 5%CO2培养箱培养2 h。收集非贴壁细胞, RPMI-1640培养液调细胞浓度为(1~2)× 106/mL, 并加入1 000 U/mL的γ -干扰素(IFN-γ )于37 ℃ 5%CO2培养箱培养, 24 h后移入经10 μ g/mL的CD3McAb包被过的培养瓶中, 加入rhIL-2终浓度为1 000 U/mL, 每3天半量换液1次, 同时补足rhIL-2。
2. DC培养
PBMC培养2 h后的贴壁细胞中, 加入含1 000 U/mL rhGM-CSF和1 000 U/mL rhIL-4的RPMI-1640培养液, 37 ℃ 5%CO2培养箱培养。每3 天半量换液, 同时补足等量上述的rhGM-CSF和rhIL-4。
3. MKN-28肿瘤抗原制备及蛋白浓度测定
MKN-28细胞置42 ℃恒温水浴热休克1 h, 37 ℃ 5%CO2培养箱恢复2 h, 0.25% 胰蛋白酶-EDTA消化, D-PBS洗涤后重悬, 调整细胞密度为1× 109/L, 液氮速冻10 min, 迅速放入37 ℃水浴融化, 反复3次, 12 000× g离心10 min, 取上清为热休克肿瘤细胞冻融抗原。二喹啉甲酸法(BCA)蛋白定量试剂盒测定蛋白含量, -20 ℃保存。
4. DC与CIK细胞共培养
第6 天将DC分成2组, 其中1组添加MKN-28肿瘤抗原, 终浓度为20 μ g/mL, 另一组不做处理, 继续按上述培养方法培养。DC培养的第7 天加入TNF-α , 终浓度为1 000 U/mL。第9 天收获DC, 将MKN-28肿瘤抗原处理过的DC和未经处理的DC 都按DC∶ CIK=1∶ 5的比例与CIK细胞混合, 培养液为CIK培养液。由此试验中的效应细胞可分成3组:单纯CIK组、未负载MKN-28抗原的DC-CIK组和负载MKN-28抗原的DC-CIK组, 分别记为CIK组、DC-CIK组和Ag-DC-CIK组。
5. DC、CIK细胞表型检测
收获成熟的DC细胞, D-PBS重悬, 调整浓度为5× 106/mL~1× 107/mL, D-PBS洗涤后各管分别加入CD83、CD86、HLA-DR 20μ L, 避光孵育15 min, 洗2次, 上机检测。取培养第9、12、14天的CIK组、DC-CIK组和Ag-DC-CIK组细胞, 操作步骤同DC细胞, 加入的抗体为CD3、CD4、CD8、CD56。
采用SPSS 11.5统计学软件处理, 数据以
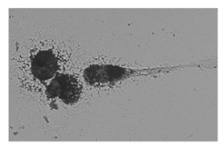
贴壁的PBMC呈圆形散在分布, 培养3~4 d, 部分DC聚集成大小不等的细胞集落, 细胞体积增大, 由圆形变为不规则形, 细胞开始出现毛刺状突起。培养6~7 d, 细胞集落明显增多, 细胞表面突起增多增长。第9天 DC成熟后, 大部分细胞悬浮, 倒置显微镜可观察到大量具有树突状突起的细胞, 具有典型的DC形态, 见图1。
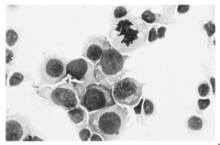
非贴壁的PBMC接种于CD3McAb包被后的培养瓶, 培养3 d后, 细胞体积增大, 开始集落生长, 并且随着培养时间的增加, 大部分细胞集落呈悬浮状态, 细胞集落增多, 细胞体积进一步增大, 细胞形态圆形、透亮。瑞氏-姬姆萨(MGG)染色可见细胞形态均一, 核大深染, 胞浆量少, 见图 2。CIK细胞于培养第3天开始增殖, 之后逐渐进入对数生长期, 第15~18天细胞数量最高。CIK细胞和DC共培养3 d后, 增殖速度明显增快, 其中Ag-DC-CIK组增殖速度最快, DC-CIK组次之, 增殖速度均远远大于单纯CIK组(P< 0.05), 见表1。
| 表1 CIK、DC-CIK与Ag-DC-CIK组不同时间增殖倍数比较( |
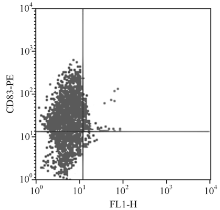
第9天分化成熟的DC经流式细胞仪分析显示, 有(75.32± 3.24)%的细胞表达成熟DC特异性表面标志CD83, (92.43± 1.17)%的细胞表达CD86, (91.86± 2.08)%的细胞表达HLA-DR, 表明PBMC经特定的细胞因子诱导后, 可以转变为成熟DC, 见图3。
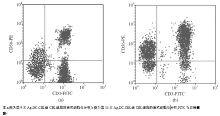
CIK细胞表面既有T细胞表面标志(CD3), 又有自然杀伤(NK)细胞表面标志(CD56)。流式细胞仪分析结果显示, 随着培养时间的延长, CIK细胞中CD3+CD8+、CD3+CD56+双阳性细胞的百分含量大幅度上升。其中Ag-DC-CIK组中CD3+CD8+、CD3+CD56+双阳性细胞的百分含量最高, 第9天CD3+CD8+、CD3+CD56+双阳性细胞分别为(61.56± 2.04)%和(22.54± 1.89)%, 第14天增长为(63.92± 1.92)%和(48.47± 2.26)%, DC-CIK组的百分含量次之, 这2组与单纯CIK组差异有统计学意义(P< 0.05), 见表2、图4。
| 表2 CIK、DC-CIK和Ag-DC-CIK组CIK细胞的免疫表型(%) |
3组效应细胞对胃癌MKN-28细胞株的杀伤活性比较见表3。在2.5∶ 1~20.0∶ 1的效靶比范围内, 各组效应细胞对MKN-28均有较强的杀伤作用, 并且杀伤作用随着效靶比的增加而增强。在相同效靶比下, Ag-DC-CIK组对MKN-28的杀伤活性最强, DC-CIK组次之, 均强于单纯CIK组(P< 0.05)。
| 表3 CIK、DC-CIK和Ag-DC-CIK组CIK细胞对MKN-28细胞株的杀伤作用(%, |
DC最初是1973年由Steinman等从小鼠脾组织中分离发现的, 是惟一能明显刺激初始型T细胞增殖的细胞, 并且其呈递抗原和刺激T细胞增殖的能力是单核巨噬细胞和B淋巴细胞的100~1 000倍, 所以DC是体内功能最强的抗原呈递细胞。DC来自CD14+或CD34+细胞, 存在于人骨髓及外周血中, 一般为非成熟状态, 体外添加细胞因子如粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素4(IL-4)、TNF-α 等刺激可将其转化为成熟状态, 发挥其抗肿瘤的作用。GM-CSF可以刺激DC产生并使其持续分化[1], IL-4可以使CD14+单核细胞分化为成熟DC, 并且使DC的成熟状态持续时间延长, TNF-α 可以提高DC呈递抗原的能力, 并且减少粒系的分化作用[2]。
近年来的研究发现, 通过热休克方法处理肿瘤细胞可以提高肿瘤细胞的免疫原性, 进而提高其负载DC的抗原呈递效率, 增强DC的抗肿瘤效应[3]。其原因是:热休克处理能够提高肿瘤细胞中HSP的表达, 而HSP本身并没有免疫原性, 是天然免疫佐剂, 可以增强抗原的免疫反应性, 进而提高抗原负载DC的抗原呈递效率。HSP可以携带肿瘤抗原与DC表面的特异性受体结合, 促进抗原的高效摄取, 也可以发挥佐剂的作用, 促进共刺激分子的表达和白细胞介素12(IL-12)的合成分泌, 增强DC的抗肿瘤免疫效应[4]。
CIK细胞是1991年Schmidt-Wolf等[5]首次报道的, 是PBMC在体外经多种细胞因子共同诱导后获得的一群异质细胞。其主要特征是同时表达T细胞表面抗原(CD3)以及NK细胞表面标志(CD56), 因此, 兼有T淋巴细胞的抗肿瘤活性和NK细胞非组织相容性复合体(MHC)限制性杀肿瘤的特点。本试验证实CIK细胞对胃癌MKN-28细胞有较强的杀肿瘤活性, 这一结果与文献结果[6, 7]基本相符。但是对比本试验中各组效应细胞可发现, DC细胞的存在与否对CIK细胞本身杀肿瘤活性的影响很大, 含有DC的效应细胞组的杀肿瘤活性明显升高。与这一结果相一致的是临床上肿瘤患者免疫功能低下, 体内功能性DC缺乏, 单纯运用CIK细胞治疗效果并不理想, 联合CIK细胞和DC共同治疗疗效明显改善, 能更好地发挥CIK细胞自身高效的细胞毒性杀伤肿瘤的能力。
Mä rten等[8]研究表明, DC和CIK细胞共培养后DC分泌 IL-12水平明显提高, CIK 细胞群中 CD3+CD56+双阳性细胞比例增加, 提高了 CIK 细胞对肿瘤细胞的细胞毒作用。在本试验中, 同样也证明CIK细胞群中CD3+CD56+双阳性细胞比例增加, 与DC共培养的CIK细胞比单纯CIK细胞具有更强的增殖能力, 并且对胃癌细胞的杀伤作用更强。作用机制可能为:成熟DC可以分泌高水平的IL-12, 有研究证实, 负载抗原的DC-CIK组分泌的IL-12水平是最高的[9]; 而IL-12可以诱导CIK细胞产生GM-CSF、TNF-α 等细胞因子, 这些细胞因子能促进DC的增殖分化和发育成熟, 从而增加DC对IL-12的分泌, 这是一个正反馈的过程。此外, DC与CIK细胞共培养可以减少CIK细胞群中的调节性T细胞的含量, 从而降低调节性T细胞对CIK细胞抗肿瘤作用的削弱[10]; DC的典型形态就是表面具有大量的树突状突起, 正因为具有这一形态特点, DC可以识别更多的抗原, 从而更有效地呈递给CIK细胞[11]。
综上所述, 热休克MKN-28细胞负载的DC与CIK细胞共培养可以增强CIK细胞对胃癌MKN-28细胞的杀伤活性, 提高CIK细胞的增殖能力, 促进CIK细胞免疫表型的表达, 这一研究结果为DC-CIK细胞应用于胃癌临床治疗提供了理论和试验依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|