作者简介:卢仁泉,男,1975年生,硕士,主管技师,主要从事临床免疫学和分子生物学工作。
通讯作者:高 翔,联系电话:021-64175590-2204。
通过人肌纤生成调节因子1(hMR-1S)基因重组表达获得MR-1S-His融合蛋白,纯化后制备抗MR-1S抗血清;同时确定该蛋白保存的稳定体系,为研究MR-1S蛋白理化性质及其功能提供关键的原料。
方法利用原核表达载体pET21a(+),构建pET21a-MR-1S重组质粒,转化大肠杆菌BL21(DE3),异丙基硫代半乳糖苷(IPTG)诱导MR-1S-His融合蛋白表达,亲和纯化后Western blot鉴定;进一步用该融合蛋白免疫新西兰兔,制备抗MR-1S的多克隆抗体。同时通过在不同温度条件下,对4种不同的稳定体系中保存后蛋白活性测定进行比较,确定最合适的稳定保存体系及条件。
结果构建了重组质粒pET21a-MR-1S,并在BL21中进行可溶性表达,经Western blot鉴定确认;免疫新西兰兔获得了抗MR-1S抗血清;确定了合适的稳定体系及保存条件。
结论在非变性条件下实现了可溶性MR-1S融合蛋白的表达和稳定保存,进一步制备的抗MR-1S抗血清为研究MR-1S的性质及功能奠定了基础。
To obtain the myofibrillogenesis regulator 1S (MR-1S)-His recombinant protein through the expression of MR-1S gene and prepare anti-MR-1S antiserum after purification. To identify the stable system to preserve the recombinant protein, and to provid the reference for the investigation of MR-1S protein characteristics and biological function.
MethodsThe recombinant plasmid pET21a-MR-1S was constructed with pronucleus expression vector pET 21a(+) and transferred into Escherichia coli BL21 (DE3), and the expression of MR-1S recombinant protein was induced by isopropyl-beta-D-thiogalactopyranoside (IPTG). The MR-1S recombinant protein was purified by affinity chromatography and identified by Western blot. The anti-MR-1S polyclonal antibodies were prepared by the rabbit-immunized technique. With comparison of the protein activities of 4 stable systems under different temperatures, the most suitable stable preservation system and condition were picked out.
ResultsRecombinant plasmid pET21a-MR-1S was established,and the MR-1S-His recombinant protein was expressed solubly in Escherichia coli BL21(DE3) by the identification of Western blot. The anti-MR-1S antisera were obtained by immunization rabbit, and the satabilization system and preservation condition were definited.
ConclusionsUnder undenatured conditions, the soluble MR-1S recombinant protein is expressed and can be preserved stably, and it lays the foundation for MR-1S characteristices and biological function studies.
人肌纤生成调节因子-1(human myofibrillogenesis regulator 1, hMR-1)是近年从人骨骼肌cDNA文库中克隆得到的一个人类新功能基因, GenBank收录号为AF417001[1]。该基因定位于2q35, 编码一个142个氨基酸组成的蛋白质, 因其在3种转录剪切异构体中长度最短, 故也称为MR-1S[2]。MR-1S在心肌、骨骼肌和肝脏中高表达, 并且参与诱导心肌肥大的发生[3, 4]; 并且与发作性非运动源性运动障碍(paroxysmal nonkinesigenic dyskinesia, PNKD)的发生、发展密切相关。近年来开始有文献报道, MR-1S和肿瘤的发生密切相关, 在肿瘤细胞的增殖、黏附和迁移发挥了重要作用[5]。
MR-1S作为一个新的功能分子, 对于其特性和作用方面的研究还刚刚兴起, 虽有文献报道了MR-1S基因的初步功能[6, 7]; 但从分子和细胞水平上具体阐述MR-1S在心肌肥大、PNKD和肿瘤等中的作用及其机制显得尤为重要, 其中特别是最近报道的在肿瘤细胞信号传递通路中发挥的作用[5, 8]。总之, 有关MR-1S分子的理化性质、功能以及与疾病之间的具体关系不甚清楚, 有待进一步探讨。因而, 我们主要进行MR-1S蛋白的表达、纯化和确定适合其保存的稳定体系以及进一步免疫动物获得抗MR-1S的抗体, 为后期研究该新蛋白分子的理化特性、功能及相关的作用机制奠定基础。
1. 质粒、菌株和细胞
质粒pUCm-T、菌株DH5α 、BL21(DE3)由本实验室保存; 质粒pET21a为教育部分子医学重点实验室惠赠; 人卵巢癌SKOV3细胞由上海市肿瘤研究所提供。
2. 引物的设计及合成
根据GenBank的人MR-1S序列, 设计一对引物(P1:5'-CG-GGATCCATGGCGGCGGTGGTAGCTGC-3'; P2:5'-CCGCTCGAGTCAGGTCTGCACCCCAGAC-3'; 分别引入BamH I和Xhol I酶切位点 (如下划线所示), 引物由上海生工生物公司合成; 目的产物片段G、C含量为60.8%, 长度为429 bp。
3. 主要试剂
Trizol试剂购自Invitrogen公司; 质粒提取试剂盒、异丙基硫代半乳糖苷(IPTG)、氮川三乙酸(NTA)树脂购自上海申能博彩生物科技有限公司; 限制性内切酶BamH I、Xhol I、T4 DNA连接酶购自NEB公司; Taq DNA聚合酶购自Fermentas公司; 鼠抗His抗体和HRP-兔抗鼠IgG购自天根生物公司; 蛋白定量试剂(BCA法)购自联科生物公司; 增强化学发光(ECL)底物购自Pierce Biotech公司。
1. 逆转录聚合酶链反应(PCR)扩增人MR-1S基因
培养SKOV3细胞至对数期, 计数约为2× 106个细胞, 严格按Trizol试剂说明书提取其总RNA。以Oligo dT为引物, 常规方法逆转录合成cDNA[9]。50 μ L PCR扩增体系为:cDNA 1 μ L, 10× Taq buffer 5 μ L, 2.5 mmol/L dNTP 5 μ L, 上下游引物各1 μ L, Taq聚合酶 1 μ L, 去离子水36 μ L; 反应条件:94 ℃ 5 min, 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 45 s, 36个循环后, 72 ℃延伸10 min; PCR产物纯化试剂盒回收该扩增产物。
2. MR-1S重组表达质粒的构建及鉴定
上述3μ L PCR产物与1μ L pUCm-T载体于16 ℃连接4 h; 转化DH5α , 接种至含X-gal的含氨苄西林琼脂平板(LBA), 37 ℃16~24 h。挑白色菌落培养后, 提取质粒进行酶切和测序鉴定。测序正确的质粒经BamH I和Xhol I双酶切后, 回收目的基因片段, 与同样酶切处理的pET21a连接过夜。转化表达菌BL21中, LBA平板上37 ℃培养过夜, 挑取阳性克隆酶切鉴定。
3. 人MR-1S融合蛋白的表达
将上述鉴定正确的阳性克隆菌扩大培养至对数生长期, 分别用不同终浓度的IPTG(0.1、0.5、1.0、1.5 mmol/L)以及不同温度条件下(28 ℃、30 ℃和35 ℃)诱导0、1、2、3、4和5 h后, 7 500× g离心10 min, 收集菌体。用10 mmol/L PBS(pH值 7.4)悬浮菌体, 加入0.3 mg/mL溶菌酶。超声裂解后, 加入10 μ g/mL DNase, 12 000× g离心10 min, 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析上清及沉淀中融合蛋白的表达情况。
4. MR-1S融合蛋白纯化及鉴定
将原核表达的MR-1S-His融合蛋白在非变性条件下经NTA柱纯化, 用不同浓度的咪唑洗脱目的蛋白, PBS透析; SDS-PAGE确定最佳洗脱的咪唑浓度。将纯化产物和诱导前BL21菌裂解物经SDS-PAGE后, 转印至聚丙二氟乙烯膜(PVDF)膜上, 5%脱脂奶粉封闭过夜; 分别与鼠抗His抗体、HRP标记的兔抗鼠IgG作用, 加增强化学发光(ECL) A、B液, X胶片显影。
5. 兔抗MR-1S抗血清的制备
将上述纯化制备的MR-1S融合蛋白用作抗原, 与弗氏完全佐剂充分乳化后, 背部多点注射免疫2只新西兰兔, 间隔2周后再同上于相同部位选不同点注射; 每次免疫的抗原量约100 μ g, 第3次起用弗氏不完全佐剂, 每次间隔2周, 共免疫5次; 末次免疫1周后耳缘静脉取血检测抗体效价。效价达到要求, 心脏采血, 5 000× g离心10 min, 收集血清, 分装, -70 ℃保存。
6. MR-1S融合蛋白稳定体系的比较
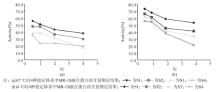
配制如下4种稳定体系。稳定体系1:含3 mmol/L乙二胺四乙酸(EDTA)的PBS; 稳定体系2:含20%小牛血清的PBS; 稳定体系3:含2 mmol/L CaCl2、10%牛血清白蛋白(BSA)的PBS; 稳定体系4:含10%BSA、50%甘油的PBS。再将纯化的融合蛋白分别用这4种稳定体系作1∶ 10稀释, 分2等份贮存于4 ℃、37 ℃各3 d、1周、2周、1个月。测定前, 用PBS配制6个浓度梯度的MR-1S标准液(1、2、4、8、16、32 μ g/mL); 取100 μ L上述标准液和不同稳定体系保存的样本加至96孔聚苯乙烯板中, 每个样本做重复孔, 4 ℃过夜; 每孔加封闭液200 μ L, 37 ℃孵育2 h; 洗孔后用1∶ 100稀释的兔抗MR-1S 多抗100 μ L加入各孔内, 37 ℃孵育1 h, 洗孔, 加1∶ 2 000稀释的辣根过氧化物酶(HRP)标记羊抗兔IgG 50 μ L, 37 ℃孵育1 h; 洗涤, 加底物缓冲液100 μ L, 37 ℃ 30 min, 加2N H2SO4 50 μ L终止反应, Bio-tek酶标仪在波长490 nm下测定A值。根据标准液的工作曲线, 换算出不同稳定体系中的样本浓度。
MR-1S基因通过PCR扩增后, 产物经琼脂糖凝胶电泳, 片段大小为429 bp, 见图1(a)。与pUCm-T载体连接、转化, 阳性克隆送测序, 结果显示该重组质粒已插入的MR-1S序列完全正确。经BamHI、Xhol I双酶切、回收目的DNA片段, 与同样双酶切的pET21a连接, 转化DH5α , 扩菌后提取重组质粒, 双酶切后能得到400 bp左右的片段, 条带与预期一致, 见图1(b)。
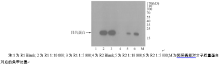
对诱导条件摸索与比较, 发现在30 ℃、IPTG 浓度为0.5 mmol/L条件下, 诱导5 h MR-1S融合蛋白表达量最多。该条件下, BL2I/pET21a-MR-1S诱导表达产物经SDS-PAGE显示, 相对分子质量21 000处有1条浓缩的条带, 占总蛋白含量的40% 以上, 见图2。同时发现诱导后超声上清和沉淀中均有目的蛋白表达, 但是大部分在超声上清中, 仅少量在超声沉淀, 说明融合蛋白呈可溶性的表达。
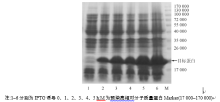
上述成功诱导表达的MR-1S-His融合蛋白, 裂解上清在非变性条件下经NTA柱亲和层析纯化, 用50和100 mol/L咪唑洗脱后目的蛋白得率、纯度均较高, 见图3(a)。将这2种浓度下的洗脱产物, 合并后用PBS透析。按BCA法试剂说明书测定蛋白浓度, 根据标准曲线计算出样品中的蛋白浓度, 测得纯化的融合蛋白浓度约为820 μ g/mL, 备用。该纯化产物和诱导前BL21菌裂解物进行Western blot分析, 发现仅纯化产物在21 000处有一条明显的发光条带, 证明已有目的蛋白存在, 条带较特异, 见图3(b)。
2只新西兰兔经5次免疫后, 心脏采血, 其中1号兔(R1)效价稍高, 酶联免疫吸附试验(ELISA)测定效价均达到1∶ 40 000以上 (抗原包被浓度为10 μ g/mL), 结果见表1。用这2种抗血清经饱和硫酸胺纯化后, 用Western blot验证其效价, 结果表明用于Western blot检测其抗体的最大稀释度均可达到1∶ 5 000。
| 表1 抗血清ELISA检测的结果 |
本研究主要是对MR-1S进行基因克隆、蛋白表达和纯化, 以及兔抗MR-1S多抗的制备, 同时也探索有利于MR-1S融合蛋白保存的稳定条件, 为MR-1S作为新肿瘤标志在临床诊疗中的应用奠定基础。首先, 将MR-1S基因接入原核表达载体pET21a, 构建可用于表达的重组质粒。pET载体系列是在大肠杆菌中克隆和表达重组蛋白的最强大系统, 能够调节基础表达水平以优化目标基因的表达, 本研究实现了MR-1S-His融合蛋白的可溶性表达, 这是已有研究的进一步改进[10]。
另外, 应用大肠杆菌BL21(DE3)作为宿主菌诱导蛋白表达时发现, 30 ℃有利于非变性条件下pET21a-MR-1S重组质粒的诱导表达及纯化。在MR-1S-His融合蛋白纯化中, 裂解产物沉淀中包涵体纯化较难, 可溶性表达在上清中进行纯化则较易获得目的蛋白。本研究采用E.Coli宿主菌BL21(DE3), 在于其优点缺失Lon和OmpT蛋白酶, 用于高效表达克隆于含有噬菌体T7启动子的表达载体的基因, T7噬菌体RNA聚合酶位于λ 噬菌体DE3区, 该区整合于BL21的染色体上[11]。因而, 在诱导表达中, pET21a-MR-1S成功地实现蛋白表达。在λ 噬菌体DE3溶原菌中, T7 RNA 聚合酶基因由lacUV5启动子控制[12]。值得一提的是, 可能由于表达一些有活性蛋白, 要求一个或2个末端没有外源序列, 而pET载体就能够克隆非融合序列, 然而如果特定翻译起始序列不能在大肠杆菌中有效利用, 表达水平就可能受影响。因此, 本研究利用了有效表达的氨基末端序列来构建了融合蛋白。本研究诱导表达的MR-1S-His融合蛋白条带位置出现在21 000左右, 与预计值相当。
此外, 本研究还摸索了MR-1S融合蛋白诱导表达的条件, 目的蛋白的表达量受多种因素如温度、时间、IPTG浓度、培养基等的影响[13], 只有载体、宿主菌和培养条件组合合适才可能用于表达后的大量纯化, 所以我们对诱导条件进行一些优化, 本研究显示MR-1S对于诱导温度较敏感, 实验发现pET21a-MR-1S诱导温度控制在30 ℃, 要优于28 ℃和35 ℃; 同时发现, 在0.5 mmol/L IPTG条件下, 诱导5 h表达量最多。
本研究也对MR-1S-His融合蛋白进行了纯化, 因为诱导表达后SDS-PAGE发现目的蛋白存在于上清和沉淀中, 但沉淀中较少, 故使用非变性的NTA层析柱纯化的方法成功获得目的蛋白。获得的融合蛋白透析后可用于标准品的配制和抗血清的制备, 因而有必要研究MR-1S融合蛋白的稳定体系。实验发现, 4 ℃条件下, 稳定体系1较利于MR-1S融合蛋白的保存。稳定体系1中主要成分为EDTA和PBS。EDTA是一种络合物, 可结合稳定体系及融合蛋白溶液中的离子, 形成稳定的水溶性络合物, 有利于融合蛋白的保存, 同时也与一些二价离子的结合, 使得空间结构稳定, 使其保持较好的免疫反应性; 稳定体系2的主要成分为血清基质, 血清基质与蛋白与体内的生存环境较为相似, 也可用于融合蛋白保存。而稳定体系3中含有CaCl2, Ca2+易改变MR-1S的蛋白空间构象, 从而影响其活性, 故稳定体系3的活性下降较多。总之, 稳定体系1、2有利于保持MR-1S的活性, 特别是稳定体系1更适合用于MR-1S融合蛋白的储存。
MR-1S蛋白作为一种新的功能蛋白, 在临床应用特别是肿瘤诊疗中, 具有较好的应用前景。本研究成功克隆出hMR-1S基因、重组表达了MR-1S蛋白、纯化并确定适合其保存的稳定体系以及进一步免疫动物获得抗MR-1S的抗体, 为进一步深入评估其功能以及研究其作用机制奠定了坚实的基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|