作者简介:黄源芳,女,1986年生,硕士,主要从事抗菌药物及耐药研究。
探讨一种快速、准确检测产超广谱β-内酰胺酶(ESBLs)革兰阴性菌的ESBLs基因分型方法。
方法双纸片法确定产ESBLs的临床分离菌,聚合酶链反应(PCR)扩增ESBLs的 SHV基因片段,用焦磷酸测序技术对29株成都市区临床分离的产ESBLs肺炎克雷伯菌和大肠埃希菌进行 SHV基因分型研究,检测 SHV基因片段中编码35位氨基酸和编码43位氨基酸位点的基因多态性。同时,采用纸片扩散法进行药物敏感性试验。
结果焦磷酸测序发现,本地区分离出的29株产ESBLs临床分离菌有21株扩增出 SHV基因片段,且在43位氨基酸密码子均没有多态性,35位密码子有基因多态性,核苷酸由T突变为A,亮氨酸变为谷氨酰胺,突变发生率达到42.9%(9/21)。29株产ESBLs的菌株对亚胺培南全部敏感;对头孢西丁、头孢吡肟、头孢他啶耐药率分别为:大肠埃希菌29.4%、11.8%、41.2%;肺炎克雷伯菌50.0%、8.3%、33.3%;对氨苄西林、哌拉西林、头孢唑啉、头孢呋辛和复方磺胺甲口恶唑的耐药性较高,均达到75%以上,对其他药物均有不同程度的耐药性。
结论焦磷酸测序技术可快速对临床分离菌产生的ESBLs耐药基因分型,具有准确、快速、实时和高通量等优点。
To investigate a method which can rapidly and accurately detect the genotyping extended-spectrum beta-lactamases(ESBLs)-producing Gram-negative bacterium.
MethodsClinical isolated ESBLs-producing strains were detected by double-disk method. SHV gene fragments of ESBLs were amplified by polymerase chain reaction(PCR). Pyrosequencing was used to study SHV genotyping of the 29 strains of ESBLs-producing Escherichia coli and Klebsiella pneumoniae isolated from hospitals in Chengdu. The gene polymorphism of amino acids site encoding 35 and 43 of SHV gene fragments were investigated. Meanwhile,antimicrobial susceptibility was determined by disk diffusion method.
ResultsThe results of pyrosequencing were that 21 of the 29 locally isolated ESBLs-producing strains had SHV gene fragments. Codon 43 amino acids had no polymorphism, while codon 35 had gene polymorphisms, nucleotide mutated from T to A, amino acids mutated from Leu to Glu, and the mutation rate reached 42.9%(9/21).All of the 29 ESBLs-producing stains were sensitive to imipenem. The resistance rates to cefoxitin,cefepime and ceftazidime were 29.4%, 11.8% and 41.2% for Escherichia coli and 50.0%, 8.3% and 33.3% for Klebsiella pneumoniae,respectively. More than 75% of the stains were highly resistant to ampicillin, piperacillin, cefazolin, cefuroxime and cotrimoxazole, while all of them were resistant to other drugs with variable degrees.
ConclusionsPyrosequencing can be used to rapidly detect resistant genotyping of clinical isolated ESBLs-producing strains with advantages of accuracy, speediness, real-time implementation and high-throughput.
β -内酰胺类广谱抗菌药物的大量使用, 已经导致了高耐药细菌的产生, 尤其是产超广谱β -内酰胺酶(ESBLs)的革兰阴性杆菌耐药性日益严重, 成为医院感染的主要致病菌。产ESBLs细菌的β -内酰胺酶基因可位于质粒上, 通过转化、转座、接合转移等方式将耐药基因在不同细菌中快速传递, 造成耐药细菌的迅速流行[1]。由于各个国家、各个地区的用药情况不同, 产ESBLs细菌的耐药基因型也有地区性差异, 加强对耐药菌的耐药基因型监测十分迫切。焦磷酸测序是近年发展起来的DNA序列分析技术[2], 可用于疾病相关基因分析、人类遗传标记的检测等。焦磷酸测序技术以短片段聚合酶链反应(PCR)为基础, 快速、准确、批量进行基因多态性分析, 此方法已开始应用于细菌鉴定、细菌基因分型及检测细菌耐药基因。35位和43位氨基酸密码子均与SHV基因分型有关, 他们是SHV基因中2个重要的点突变位点, 监测这2个位点对流行病学研究有重要意义[3]。35位氨基酸改变可影响宿主菌的耐药水平[4]。43位氨基酸改变对耐药性的影响未见报道, 尚需进一步研究。本研究将通过焦磷酸测序技术对肺炎克雷伯菌和大肠埃希菌进行SHV基因35位和43位密码子基因多态性分析, 以探讨一种快速分型的方法。
1.菌株
2010年11至12月, 四川省成都市第二人民医院临床分离的65株革兰阴性菌, 包括大肠埃希菌42株、肺炎克雷伯菌23株。质控菌株为大肠埃希菌(ATCC 25922)和肺炎克雷伯菌(ATCC 700603)。
2.仪器和试剂
9700型PCR扩增仪(美国ABI公司), GelDoc2000凝胶成像系统(美国BIO-RAD公司), PyroMark Q96 ID型焦磷酸测序仪(德国QIAGEN公司); 质粒提取试剂盒(Plamid Mini Kit I, 美国OMEGA公司), 2× Taq Master Mix(上海欣百诺生物科技有限公司), 焦磷酸测序试剂盒(PyroMark Gold Q96 Reagents)、磁珠纯化试剂盒(Sepharose beads, 德国QIAGEN公司)。
3.药物敏感性纸片及药物敏感性试验培养基
氨苄西林、哌拉西林、头孢唑啉、头孢呋辛、头孢噻肟、头孢他啶、头孢哌酮、头孢吡肟、头孢西丁、亚胺培南、妥布霉素、左氧氟沙星、复方磺胺甲口恶唑、头孢噻肟-克拉维酸、头孢他啶-克拉维酸均购自杭州天和微生物试剂有限公司; 水解酪蛋白胨(MH)肉汤及MH琼脂培养基均购自北京奥博星生物技术有限责任公司。
1.ESBLs表型确证试验
采用双纸片法测定ESBLs, 具体方法为挑取过夜培养的MH琼脂培养皿上数个菌落置于生理盐水中, 校正浓度至0.5麦氏单位, 用无菌棉签蘸取菌液后均匀涂布在MH琼脂表面, 将头孢噻肟、头孢噻肟-克拉维酸, 头孢他啶、头孢他啶-克拉维酸贴于琼脂表面, (35± 2)℃孵育16~18 h后量取抑菌圈的直径。头孢噻肟与头孢噻肟-克拉维酸或头孢他啶与头孢他啶-克拉维酸的抑菌圈直径之差≥ 5 mm可判定为ESBLs阳性菌株。
2.药物敏感性试验
采用纸片扩散法测定产ESBLs菌株对14种常用抗菌药物的敏感性。将0.5麦氏浓度的菌液均匀涂布在MH琼脂表面, 再将各种药物敏感性纸片贴于琼脂表面, (35± 2)℃孵育16~18h后量取抑菌圈的直径。采用美国临床试验室标准化协会(CLSI)2009年版标准判断药物敏感性试验结果。
3.细菌质粒DNA的提取
根据质粒提取试剂盒说明书步骤提取产ESBLs菌株的质粒DNA, -20 ℃保存备用。
4.焦磷酸测序
(1)SHV基因PCR片段引物设计:SHV基因序列查自GenBank, 登录号为AF124984。因焦磷酸测序技术需要将SHV基因产物片段设计成500 bp左右, 用primer5软件设计。引物序列见表1。引物由上海生工生物工程有限公司合成。生物素标记正向引物, 以备进一步用于焦磷酸测序, 得到的焦磷酸测序序列为其反义链的序列; (2)PCR扩增:将全部的细菌质粒DNA测定浓度, 稀释成10 ng/μ L, 作为最终的DNA模板。采用50 μ L体系进行PCR扩增:P1引物1 μ L(10 pmol/μ L), P2引物1 μ L(10 pmol/μ L), 模板液1 μ L(10 ng/μ L), 2× Taq Master Mix 25 μ L, 加超纯水至50 μ L。PCR 扩增热循环参数为:95 ℃预变性5 min, 然后95 ℃ 30 s→ 57 ℃ 30 s→ 72 ℃ 30 s, 共45个循环, 最后72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳, 用凝胶成像仪拍照, 条带清晰者用焦磷酸测序; (3)焦磷酸测序:①测序引物设计。根据国内外报道SHV基因片段中有多态性的基因位点, 查找编码35位氨基酸和编码43位氨基酸的基因位点, 用SNP Software AQ (Pyrosequencing AB)软件设计测序引物和分析引物, 测序引物见表1; ② PCR产物纯化及测序。PCR产物用磁珠纯化, 制备单链PCR模板。将PCR产物移至96孔PCR板中, 每孔加入40 μ L的binding buffer和3 μ L的磁珠, 室温振摇10 min。依次用70%乙醇、0.2 mol/L NaOH和washing buffer各洗5~10 s, 纯化PCR产物, 制备单链PCR模板。将单链PCR模板放入含有45 μ L annealing buffer和5 μ L测序引物的96孔测序板中, 在85 ℃的烘箱孵育2 min后取出, 自然冷却至室温以进行焦磷酸测序。打开PyroMarkID测序软件, 选择单核苷酸多态性(SNP)分析软件, 按软件给出的数值加入酶混合物、底物混合物以及4种dNTP, 进行焦磷酸自动测序。
| 表1 SHV基因的扩增引物和测序引物 |
5. 双脱氧核糖核酸链末端终止法(Sanger)测序
将SHV基因的PCR扩增产物进行Sanger测序, SHV用反向引物测序, 测序由上海生工生物工程有限公司完成。
42株大肠埃希菌中, 有17株菌产ESBLs, 阳性率为40.5%; 23株肺炎克雷伯菌中, 有12株菌产ESBLs, 阳性率为54.5%。
质控菌株为大肠埃希菌(ATCC 25922)和肺炎克雷伯菌(ATCC 700603)。17株大肠埃希菌对氨苄西林、头孢唑啉和头孢呋辛的耐药率为100.0%, 对哌拉西林和复方磺胺甲口恶唑的耐药率为88.2%; 12株肺炎克雷伯菌对氨苄西林的耐药率为100.0%, 对哌拉西林、头孢唑啉、头孢呋辛和复方磺胺甲口恶唑的耐药率均为75.0%以上; 头孢吡肟对大肠埃希菌和肺炎克雷伯菌有较好的抗菌活性, 敏感性分别为88.2%和75.0%; 29株菌未发现亚胺培南耐药株, 但对其他药物表现出不同程度的耐药。29株产ESBLs菌对常用抗菌药物的药物敏感性试验结果见表2。
| 表2 产ESBLs的大肠埃希菌和肺炎克雷伯菌的耐药率(%) |
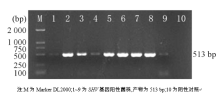
将29株产ESBLs菌的DNA模板进行PCR扩增, PCR扩增产物经2%琼脂糖凝胶电泳20 min, 得到513 bp大小的PCR产物, 29株菌中有21株菌有SHV基因扩增产物, 琼脂糖凝胶电泳图见图1。经测序证实为SHV基因片段。
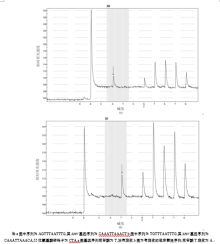
将SHV基因的PCR扩增产物进行焦磷酸测序, 检测目标氨基酸的突变情况。焦磷酸测序采用SNP分析软件进行分析。在所测的编码SHV基因的35位和43位氨基酸密码子的基因位点中, 21株临床分离菌中有9株菌35位密码子发现有多态性, 核苷酸由T突变为A, 使得氨基酸发生改变, 从亮氨酸变为谷氨酰胺, 见图2, 突变率为42.9%。43位密码子基因无多态性, 核苷酸均为C, 氨基酸为精氨酸, 见图3。
研究结果显示, 43位密码子没有单核苷酸多态性, 说明此种突变在成都地区比较少见; 而35位密码子的单核苷酸多态性比较常见, 突变发生率较高, 达到42.9%(9/21)。
PCR扩增SHV基因并进行焦磷酸测序, 得到的结果与Sanger测序结果进行比对, 两者是完全一致的。但PCR联合焦磷酸测序技术所用时间较少, 能在3 h内完成96个样本的测序。
革兰阴性菌对β -内酰胺类药物的主要耐药机制为产生β -内酰胺酶。产ESBLs的菌株对临床常用的抗菌药物广泛耐药, 使得治疗越来越困难, 且呈现出逐年增加的趋势[5]。大肠埃希菌的阳性检出率为40.5%, 肺炎克雷伯菌的阳性检出率为54.5%, 均有较高的阳性率。
药物敏感性试验结果显示, 29株产ESBLs的菌株对亚胺培南全部敏感, 故碳青霉烯类药物可作为治疗产ESBLs菌株的首选药物。头孢吡肟对大肠埃希菌和肺炎克雷伯菌有较好的抗菌活性, 分别为88.2%和75.0%。但有2项研究结果显示, 应用头孢吡肟治疗大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌感染, 可因SHV型ESBLs的存在而使药物失去抗菌活性[6, 7]。29株产ESBLs的菌株对氨苄西林、哌拉西林、头孢唑啉、头孢呋辛、左氧氟沙星和复方磺胺甲口恶唑的耐药性较高, 均达到75.0%以上, 对其他药物均有不同程度的耐药性。
ESBLs的快速鉴定可为临床治疗提供合理的治疗方案, 也可降低耐药性的发生率, 但每种类型ESBLs的大量突变需要进行测序才能进一步分型。目前, 已经应用PCR结合焦磷酸测序技术检测CTX-M型β -内酰胺酶的5种亚型[8], 从本试验结果可见, 应用PCR结合焦磷酸测序技术可以同时检测SHV型β -内酰胺酶的多个突变点。
焦磷酸测序技术使用SNP分析软件, 适合于基因的复等位基因分析, 如临床分离菌是产ESBLs型还是非产ESBLs型, 也可检测细菌是TEM型还是SHV型, 致病菌重要耐药基因的复等位基因是常见的[3]。如一项有关ESBLs基因的调查发现, 来自全世界的替加环素临床试验得到的临床分离菌, 52%的细菌编码多种SHV型酶(包括ESBLs和非ESBLs)[9]。本研究中, 使用SNP软件分析SHV基因的35位和43位密码子。35位密码子突变可使亮氨酸变为谷氨酰胺(L35Q); 43位密码子突变, 可使精氨酸变为丝氨酸(R43S)。根据氨基酸的改变, 到SHV beta-lactamase Engineering Database(http://www.laced.uni-stuttgart.de/classA/SHVED/)比对, 即可对SHV基因进行分型。35位氨基酸的单独改变为SHV-11基因; 35位氨基酸联合其他氨基酸改变, 可以有49种SHV亚型。目前尚未发现43位氨基酸的单独改变; 43位氨基酸联合其他氨基酸改变, 可以有7种SHV亚型。本研究结果显示, 43位密码子没有突变, 说明了成都地区的SHV型ESBLs与国外存在差异; 35位密码子核苷酸T突变为A, 使氨基酸从亮氨酸变为谷氨酰胺, 与国外报道一致[3]。因此, 本研究中35位氨基酸有改变的菌株可能为SHV-11基因, 也可能为其余49种亚型中的一种。检测其余相关的核酸序列, 即可将菌株进行准确分型。SHV基因所有位点均无突变的菌株则为SHV-1基因。使用焦磷酸测序可以检测SHV基因的多个SNP位点, 且可在1 h内完成96个样本的SNP分析。焦磷酸测序技术是一种短序列实时合成的检测技术, 对SNP的检测有明显的价值, 可进行SHV型ESBLs的鉴定[3]。这种检测SNP位点的方法可以扩展到检测各种ESBLs和其他的耐药基因型, 有助于临床开展耐药基因的突变研究和监测, 以提高临床疗效。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|