通讯作者:陈伟华,联系电话:021-0755845。
作者简介:王巧燕,女,1977年生,学士,主管技师,主要从事免疫、PCR检验工作。
人乳头瘤病毒(HPV)感染是宫颈癌的主要致病元凶,研究表明99.7%的宫颈癌患者存在HPV感染[ 1]。由于HPV感染与宫颈癌的高度相关性,而HPV阴性者几乎不会发生宫颈癌。而且HPV感染与宫颈癌的发生有时序关系,符合生物学致病机理。现有研究都强有力的支持了HPV感染与宫颈癌之间的因果关系,表明HPV感染是宫颈癌发生的必要病因条件[ 2]。所以在临床上对宫颈癌的筛查中进行HPV DNA的检测是一项极为必要和有临床价值的筛查手段[ 3]。目前国际上很多发达国家都已经将HPV DNA检测列为宫颈癌筛查的必检项目,并已经列入宫颈癌诊断防治指南中[ 4, 5],而这些筛查手段在发展中国家包括中国还远未普及。目前国内临床上进行HPV DNA检测的主要方法有实时荧光聚合酶链反应(PCR)法、基因芯片法、杂交捕获法(Hybrid Capture II,HC-Ⅱ)。这3种方法作为临床宫颈癌筛查的手段各有优劣,我们从方法学的角度进行综合性分析和比较,可为临床宫颈癌筛查方法选择提供借鉴和参考。
HC-Ⅱ是美国Digene公司开发生产的,已获美国药品食品监督管理局(FDA)批准用于临床HPV DNA检测的技术,在国内也被引进到一些医院用于临床HPV DNA检测和宫颈癌筛查[ 6, 7]。HC-Ⅱ本质上是基因杂交信号放大技术,采用分子杂交和化学发光信号放大的原理,无需基因扩增,属于线性级数放大。见 图1。该技术采用全长8 000个碱基的RNA探针,靶DNA变性为单链后与RNA探针杂交,形成DNA-RNA杂交体,再被包被了抗DNA-RNA杂交体抗体的微孔板捕获,DNA-RNA杂交体与标有多个碱性磷酸酶的第2抗体结合,通过酶化学发光测定信号强度,与标准品比较有软件计算出样本中靶核酸的浓度。HC-Ⅱ技术实际上是核酸杂交、免疫反应和化学发光技术的综合运用,具有HPV分群(高危群和低危群)功能,但不具有精确分型功能。该方法采用半自动检测方式,杂交温浴、洗涤、光采集仪操作分步进行,手动转移操作。
 | 图1 HC-Ⅱ的检测原理注:1为样本DNA双链被释放并分解为核苷酸单链;2为DNA单链与RNA探针结合为DNA/RNA杂交体;3为第1抗体将DNA/RNA杂交体固定在试管壁或微孔壁上;4为结合有碱性磷酸酶的多个第2抗体与DNA/RNA杂交体结合,使信号放大;5为碱性磷酸酶使底物发光,判读光的强弱可确定碱性磷酸酶的含量,从而确定DNA/RNA的含量 |
该方法已经广泛地用于宫颈癌的筛查和随访。HC-Ⅱ发现高度鳞状上皮内病变(HSIL)的灵敏度为95%,明显优于液基细胞学,但是特异度为85%,略低于液基细胞学。由于该方法在国外开发及上市较早,国内后来开发的其他方法学HPV DNA检测试剂基本上都与该方法学做临床比对和验证。虽然尚不能成为HPV诊断金标准,但也为后来国内HPV诊断试剂的研发提供了一个极有价值的参照体系。但是随着近年来国内外的广泛应用,也逐渐暴露出一些临床上的缺点和问题[ 8]。比如易产生交叉污染,成本费用较高,高危型与低危型存在一定的交叉反应[ 9],并且国外已有文献报道存在个别的高危型漏检率[ 8]。
基因芯片法是指在固相支持物上原位合成寡核苷酸或者直接将大量DNA探针以显微打印的方式有序地固化于支持物表面,然后与标记的样本杂交,通过对杂交信号的检测分析,得出样本的遗传信息(基因序列和表达信息)。目前国内的基因芯片法HPV检测试剂都是采用PCR体外扩增和DNA反向点杂交相结合的DNA芯片技术。通过对HPV基因分型检测,可将不同HPV型别感染与宫颈病变的关系研究的更深入,有很高的学术研究价值[ 10]。同时还可以指导HPV疫苗的研究及临床使用。
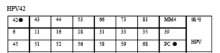
目前国内的HPV基因分型检测试剂盒,均利用HPV的基因特点设计特异引物,最多可以同时扩增出23种HPV基因型的目标片段,包括18种高危型和5种低危型,然后再将扩增产物与固定在膜条上的包括高危型和低危型在内的分型探针进行杂交,依据杂交信号的有无来对HPV 的感染情况进行定性检测并加以分型[ 11, 12]。可检测的HPV型别包括18种高危型(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、83、MM4)以及5种低危型(HPV6、11、42、43、44)。该方法可用于临床HPV感染的辅助诊断和科研工作。
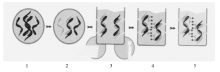
基因芯片法的检测结果只能对样本进行定性分析,以检测位点出现信号与否来进行判断,信号点的强弱不能提供定量方面的参考。除PC位点外膜条上各检测位点有信号,说明感染了相应基因型的HPV,包括单一感染和混合感染,见 图2、 图3;检测位点无信号,说明未感染本品包含的23种基因型HPV。
另外毕竟基因芯片法要比实时PCR多一步杂交显色,所以总体上操作步骤还是比实时荧光PCR相对繁琐一些。由于PCR扩增后,还需要开盖进行杂交实验,增加了实验室PCR产物污染的风险,有可能造成实验结果的假阳性。因此在实验室条件和操作水平能够完全保证的前提下,基因芯片法不失为一种很好的HPV DNA检测和分型方法。
实时荧光PCR技术在常规PCR基础上加入荧光标记探针,从PCR扩增到得出结果是在完全封闭的系统中运行,无需PCR后处理,从而避免了扩增产物污染和交叉污染的可能性。同时在扩增时结合了特异探针的杂交,进一步提高了实验的敏感性和特异性,而且可以实时荧光监测扩增过程,结果准确可靠,非常适合用于临床的大面积筛查[ 13, 14]。而且可一次同时检测多种HPV不同亚型的DNA,弥补了传统电泳法检测的不足。荧光PCR法检测为阳性即可对HPV阳性感染进行确诊,目前实时荧光PCR技术已越来越广泛的应用于HPV的临床检测。以目前国内的HPV检测试剂为例,可用于常见高危HPV亚型(HPV16、18、31、33、35、45、52、53、56、58)等的检测。对于HPV高危型阳性检测结果,需要进行严格的跟踪检查,协助临床诊断。由于此法检测宫颈HPV感染具有快速、简便、准确的优点,且适用于多种样本类型,成本相对较低,在严格进行实验实质量控制的情况下,该法为临床上HPV检测的一种理想方法。取材后可放置冰箱冷藏,再送至PCR实验室进行大批量的检测,无需另外添置杂交仪和基因芯片阅读仪,有利于在基层进行大规模群体筛查。
自2008年诺贝尔医学和生理学奖被颁发给德国科学家哈拉尔德·楚尔·豪森,因其发现HPV引发子宫颈癌获此殊荣。国内外对于宫颈癌和HPV的研究也如火如荼,成为全世界备受关注的焦点课题。HPV检测技术的不断发展和进步不但对HPV相关疾病的研究起了巨大推动作用,也为临床上开展HPV相关的检测服务提供了一系列可靠的方法和手段。我们主要针对目前国内市场上主要的3种HPV DNA检测方法进行了相对比较细致的介绍和方法学探讨(见 表1),以期望能够对于临床开展HPV检测项目,进行产品和方法学选择有所帮助。
| 表1 常用的HPV DNA检测方法的比较 |
HC-Ⅱ是美国Digene公司最早开发生产的用于HPV DNA检测的较成熟产品,也较早的进入国内临床进行HPV项目检测。随着近年来国内外的广泛应用,也逐渐暴露出一些临床上的缺点和问题,比如易产生交叉污染,成本费用较高,高危型与低危型存在一定的交叉反应等[ 9],并且国外已有文献报道存在个别的高危型漏检[ 8]。另外随着实时荧光PCR技术和基因芯片技术的大规模发展,国内也产生了很多基于荧光PCR和基因芯片技术的HPV检测产品,使得临床上进行HPV检测有了更多的方法学选择余地。
基因芯片法可以对患者所感染的HPV类型进行具体的分型,也可以同时检测高危型和低危型HPV病毒。因此可以通过一次实验检测获得相对较多的检验信息,为临床提供更多的诊断依据和参考价值。但是目前国内外专家和学者的研究均表明,对于感染不同型别的高危型HPV,患者的临床治疗方案和方法均没有任何差别[ 15]。即只要是感染了HPV高危型病毒,均需要对患者进行持续的病毒监测和细胞学检查,必要时还需进行阴道镜检确诊。然后再根据这些相关的诊断结果,综合考虑再确定是进行药物治疗、物理治疗或是手术治疗,对于已经确诊罹患宫颈癌的患者还需进行相应抗癌治疗。而且不同型别的HPV也尚未发现对于同一种治疗药物的应答情况有明显差异。因此基于以上事实可以说,目前前临床上对于HPV病毒进行检测具有临床诊疗意义,而精确的分型检测并没有什么实际的临床诊疗意义。对于HPV进行精确的分型检测更大的意义可能在于其学术研究价值,比如对不同HPV型别感染与宫颈病变的关系可以进行更深入的研究,以及疫苗研发和临床使用进行指导[ 16]。
另外,对于宫颈癌筛查,原则上应该只筛查高危型,筛查低危型是没有临床意义的。因为只有高危型HPV的持续感染才是引起宫颈癌的元凶。因为高危HPV基因组能整合进宿主细胞染色体[ 17, 18]。因此基于实时荧光PCR技术的高危型HPV DNA检测试剂盒作为宫颈癌筛查的工具,可以为临床的诊断和治疗提供科学而且准确的依据。
在HPV检测的方法学选择上医院需根据自身情况,选择更适合于自己实际情况和临床需求的HPV检测方法。一方面能更加快速、准确的进行HPV检测,及时为患者提供可靠的检测报告;另一方面又能满足临床的需求,为临床医生提供更有价值的检验结果。同时还要兼顾检测成本,在不增加大的投入的情况下顺利地开展HPV DNA检测项目。如果不考虑临床实际的需求和自身实验室实际情况,一味的盲目效仿推行HPV杂交分型并同时检测高危和低危型,会有过度检验之嫌,增加医院和患者的检验成本。此外,倘若在实验室质量控制措施不能充分保证的前提下,基于杂交法原理的检测方法也极易导致交叉污染产生假阳性结果。
展望HPV临床检测的未来,随着技术的不断进步、产品准入和审批的逐步严格、市场管理和监督的不断规范,临床可用于HPV检测的产品也必将得到的不断完善和发展[ 19]。这必将造福于中国的女性,随着HPV的筛查逐步普及必将会让更多的中国女性远离宫颈癌的威胁。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|