作者简介:田国力,女,1968年生,硕士,主任技师,主要从事新生儿遗传代谢病筛查工作。
建立非衍生化串联质谱检测酰基肉碱的方法,以便用于有机酸和脂肪酸代谢病的检测和筛查。
方法使用含13种稳定同位素标记的酰基肉碱内标准品的溶剂萃取滤纸干血片中的游离肉碱和酰基肉碱,串联质谱仪直接进样,检测游离肉碱(C0)、乙酰基肉碱(C2)、丙酰基肉碱(C3)、丁酰基肉碱(C4)、异戊酰基肉碱(C5)、戊二酰基肉碱(C5DC)、己酰基肉碱(C6)、辛酰基肉碱(C8)、葵酰基肉碱(C10)、十二烷酰基肉碱(C12)、十四烷酰基肉碱(C14)、十六烷酰基肉碱(C16)和十八烷酰基肉碱(C18)的浓度。分析该方法的精确性、准确性及稀释回收率。
结果低浓度酰基肉碱的批内变异系数(
非衍生化串联质谱检测酰基肉碱有较高的精确性和准确度,有临床应用价值。此技术可以作为新生儿遗传代谢病筛查的常规技术。
To establish the non-derivatized tandem mass spectrometry(MS/MS) method to detect acylcarnitines for the detection and screening of the organic acid and fatty acid metabolism disorders.
MethodsThe measurement of free carnitine and acylcarnitines, including free carnitine(C0), acetylcarnitine (C2), propionylcarnitine(C3), butyrylcarnitine(C4), isovalerylcarnitine (C5), glutarylcarnitine (C5DC), hexanoylcarnitine(C6), octanoylcarnitine (C8), decanoylcarnitine (C10), dodecanoylcarnitine(C12), tetradecanoylcarnitine(C14), hexadecanoylcarnitine (C16) and octadecanoylcarnitine (C18), involved extraction of dried blood spots with a solution containing 13 stable-isotope labeled internal standards and analysis by MS/MS system. The precision, accuracy and recovery of the method were analyzed.
ResultsThe within-run coefficient of variation (
The high precision and accuracy non-derivatized MS/MS method has the value of clinical application. The method should be applied as a regular technique in the newborn screening for inherited metabolic disorders.
国际新生儿遗传代谢病筛查发展趋势逐步提高到以串联质谱技术为中心的筛查。通过检测滤纸干血片中氨基酸和酰基肉碱浓度,进行氨基酸代谢、有机酸和脂肪酸代谢障碍等的筛查,使患儿得到早期诊断和及时治疗,避免体格和智力发育障碍[ 1]。我们应用非衍生化样本处理的串联质谱技术(tandem mass spectrometry, MS/MS)检测13种酰基肉碱浓度,以便用于有机酸和脂肪酸代谢病的检测和筛查。
1. 样本 为滤纸干血片样本。采集微量血滴于S&S903滤纸上,室温下自然晾干,-20 ℃冰箱保存待用。
2. 试剂 非衍生化串联质谱试剂盒(NeoBase Non-derivatized MS/MS Kit, 美国PerkinElmer公司出品)。酰基肉碱同位素内标共13种,分别为2H9-肉碱(2H9-carnitine, C0),2H3-乙酰基肉碱(2H3-acetylcarnitine, C2),2H3-丙酰基肉碱 (2H3-propionylcarnitine, C3),2H3-丁酰基肉碱 (2H3-butyrylcarnitine, C4),2H9-异戊酰基肉碱 (2H9-isovalerylcarnitine, C5),2H6-戊二酰基肉碱 (2H6- glutarylcarnitine,C5DC),2H3-己酰基肉碱 (2H3-hexanoylcarnitine, C6),2H3-辛酰基肉碱 (2H3-octanoylcarnitine, C8),2H3-葵酰基肉碱 (2H3-decanoylcarnitine,C10),2H3-月桂酰基肉碱 (2H3-lauroylcarnitine, C12),2H3-肉豆蔻酰基肉碱 (2H3-myristoylcarnitine,C14),2H3- 棕榈酰基肉碱(2H3-palmitoylcarnitine, C16),2H3-十八碳酰基肉碱 (2H3-octadecanoylcarnitine, C18)
3. 仪器 串联质谱系统[包括质谱仪(MS/MS, Waters Quatto micro)、高效液相仪(Waters 1525u)、自动进样系统 (Waters 2777 Sample manager)]为美国Waters公司产品;孵育震荡仪(Labsystems iEMS)为芬兰雷勃公司产品。
1. 原理 使用包含13种稳定同位素标记的酰基肉碱内标准品的溶剂萃取滤纸干血片中的游离肉碱和酰基肉碱,然后用MS/MS系统进行分析。质谱将被测物质分子电离成各种质荷比(m/z)不同的带电粒子。这些带电粒子按照m/z大小在空间或时间上产生分离形成质谱图谱。通过测定每个酰基肉碱与其对应的同位素内标的离子峰强度,由已知水平的内标,即可自动计算出所测样本的酰基肉碱水平。
2. 实验步骤 用直径3 mm打孔器在滤纸血片上取样,置于96孔板中,每孔加入甲醇和酰基肉碱同位素内标 (PerkinElmer Neogram) 混合液100 μL,45 ℃密封孵育震荡(650~750 r/min)45 min,提取75 μL萃取液转移至V型底检测板内,铝膜覆盖,上机检测。
3. 仪器设置 流动相采用80%甲醇,四元泵流速设置为变速,即0~0.2 min为0.12 mL/min; 0.2~1.2 min为0.015 mL/min; 1.2~1.5 min为0.5 mL/min; 1.5~0 min为0.12 mL/min。使用串联质谱仪电喷雾阳离子扫描,多反应监测(MRM)模式收集数据。每份样本测定时间为1.5 min,进样量为20 μL。
4. 精密度测定 取试剂盒内提供的高、低2个水平的质控品,每次各测定20个样本,连续测定20 d,得出批内和批间变异系数( CV)。
5. 准确度测定 取美国疾病预防控制中心(CDC)提供的5个不同批号室间质控品进行检测,对其中的11种酰基肉碱(C2、C12除外)进行分析,计算检测值与“靶值”的相对偏倚。
6. 线性实验 取试剂盒内高浓度质控,用打孔钳取直径3 mm的血斑,分别取1、1/2、1/4、1/8血斑作为系列浓度样本,每个样本重复检测3次。作稀释回收实验,稀释回收率=(实测值/预期值)×100%。
低浓度酰基肉碱的批内 CV为6.61%10.97%,平均为8.06%;批间 CV为13.31%18.98%,平均为16.94%。高浓度酰基肉碱的批内 CV为5.74%12.13%,平均为7.24%;批间 CV为 12.70%18.88%,平均为15.38%。见 表1、2。
| 表1 低浓度酰基肉碱的批内、批间 CV |
| 表2 高浓度酰基肉碱的批内、批间 CV |
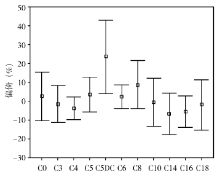
除C5DC外,其他10种酰基肉碱的偏倚为-15%~20%,平均相对偏倚为7.97%,有较高的准确性。C5DC的偏倚为0.62%40%,平均为23.6%。见 图1。
除C5DC在1∶8稀释时的回收率为79.61%外,其他的酰基肉碱不同稀释浓度的回收率均在90%~115%之间,平均为102.77%。实测值与预测值间回归统计结果显示均为一次线性,相关系数( r)为0.970.99,有高度的相关性( P>0.05)。
在500例因喂养困难、黄疸延迟等入院的新生儿中分别检出甲基丙二酸血症、丙酸血症和极长链酰基辅酶A脱氢酶缺乏症各1例,其MS/MS结果见 表3。
| 表3 3例确诊患儿串联质谱检测结果(μmol/L) |
遗传代谢病是由于单基因缺陷引起的代谢通路阻断,为一类以功能障碍为主要表现的遗传性出生缺陷。当人患了代谢疾病,正常的代谢途径就被阻断,反应的原始物质积累,生成那些在正常人体内部出现的不正常的代谢终产物。因此检测那些不正常的代谢终产物,被阻断的反应途径和疾病就能诊断[ 2]。许多有机酸和脂肪酸代谢性疾病常常伴有酰基肉碱的增高或降低。
检测肉碱的方法有很多,包括放射同位素酶化学法、放射性同位素检测法、高效液相色谱法等,但这些方法均不能同时检测多种酰基肉碱。近年来国外采用MS/MS,即2个质谱仪经一个碰撞室串联后,一次进行二级检测,能在23 min内对一个样本进行多种酰基肉碱的检测,具有特异性强、灵敏度高的特点[ 3]。本研究结果显示所测的低、高浓度酰基肉碱批内的 CV平均为 8.06%和7.24%,批间 CV为16.94%和15.38%,表明MS/MS测定酰基肉碱具有较高的精确性。
质谱将被测物质分子电离成各种m/z不同的带电粒子,由不同的扫描方式进行检测。常用的有子离子扫描、母离子扫描、中性丢失扫描和MRM扫描方式,其中MRM可以同时检测多对母-子离子对,是定量分析最好的方式[ 4]。本研究采用此模式收集数据,结果显示在美国CDC监控的11种酰基肉碱中,除C5DC外,其余10种酰基肉碱偏倚在-15%~20%之间,平均相对偏倚为7.97%;对于反复稀释后测定的酰基肉碱,与预测值间显示有很好的线性关系, r为0.970.99,各浓度的回收率均在90%115%之间。这些研究均表明MS/MS测定酰基肉碱有较高的准确度。
目前MS/MS进行酰基肉碱检测的样本前处理有2种方法,即衍生法和非衍生法。非衍生化方法无需使用盐酸正丁醇将待测物衍生化,省去了盐酸反应对环境的污染,省去了吹干、复溶等过程,萃取过程节省近2 h,使整个样本预处理步骤仅需30 min。但非衍生法对同分异构体检测准确度相对低,如C5DC和3-羟基丁酰基肉碱(C4OH),不能很好区分[ 5]。本研究中C5DC的检测值与靶值的偏倚为0.62%~40%,平均为23.6%,是其他酰基肉碱的近3倍;在稀释8倍后,其回收率也仅为79.61%,估计是由于受样本中C4OH的影响所致。但据美国CDC统计,在参加其举办的酰基肉碱检测的室间质量评价的近1 100家实验室,近3年来采用非衍生化前处理的实验室与采用衍生化前处理样本的实验室比较,2007年占12.20%,2008年占17.80%,2009年占22.24%[ 6],仍呈逐年上升趋势。非衍生化法是新生儿遗传代谢病筛查实验室的发展方向。
自上世纪90年代起, MS/MS用于遗传代谢病的筛查诊断,大大扩展了筛查的疾病谱,是开展新生儿筛查史上最重要的进展[ 7]。美国、法国、英国、澳大利亚、德国、西班牙、韩国、瑞典、丹麦、加拿大等国家均将MS/MS应用于新生儿疾病筛查;我国台湾地区2000年成功引入MS/MS后,目前在全岛范围内常规开展中链酰基辅酶A脱氢酶缺乏症(MCAD)等11项疾病筛查[ 8]。本研究采用非衍生化样本前处理方法,测定500例因喂养困难、黄疸延迟等入院的新生儿,确诊甲基丙二酸血症、丙酸血症和极长链酰基辅酶A脱氢酶缺乏症各1例,表明MS/MS技术有较高的临床应用价值。提示随着疾病谱的改变,国内应提倡将MS/MS技术作为新生儿遗传代谢病筛查的常规技术。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|