作者简介:郭龙华,男,1970年生,硕士,副主任技师,主要从事临床生物化学检验工作。
依据美国临床实验室标准化协会(CLSI)EP7-A2文件评价肝素对速率法测定亮氨酸氨基肽酶(LAP)的干扰,明确干扰物质带来的结果差异,确保分析方法性能符合临床要求。
方法首先,使用2个不同厂家[北京利德曼生化股份有限公司(简称利德曼)、日本第一化学药品株氏会社(简称日本一化)]的试剂同时测定40例患者不抗凝血样本和肝素锂抗凝血样本的LAP,对2种样本的LAP结果进行分析,对有差异的结果进行干扰筛选分析。然后,分别进行“配对差异”试验和“剂量效应”试验以及肝素干扰LAP测定的浓度范围的评价。
结果利德曼试剂测定2种样本LAP的结果有差异(
当样本LAP≤97 U/L时,用利德曼试剂测定肝素锂抗凝样本LAP时会对检测结果产生正干扰。为保证LAP检测结果的准确性,如果继续使用利德曼LAP试剂,则需换用无抗凝的干燥管采集样本;如果继续使用肝素锂抗凝管采集样本,可换用日本一化LAP试剂。
To investigate on the interference and its results' difference of heparin in the determination of leucine aminopeptidase(LAP) by rate method according to EP7-A2 document from Clinical Laboratory of Standards Institute (CLSI), and ensure that the analysis performance meets the clinical requirements.
MethodsThe LAP of the 40 blood specimens were divided each in 2 tubes:one without anticoagulant and another with heparin lithium-anticoagulant, which were measured for LAP by 2 manufacturers' LAP reagents (Beijing Leadman Biochemistry Co., Ltd and Daiichi Pure Chemicals Co., Ltd) respectively. The results of LAP were analyzed. The interference screening test based on the difference of results. The "paired difference" experiment and "dose-response" experiment were determined. LAP concentration range of heparin interference was evaluated.
ResultsThere was difference in the LAP determination result with Beijing Leadman reagents (
If the LAP concentration is ≤97 U/L,the test results will be interfered when the heparin anticoagulant specimens are tested by LAP reagents of Beijing Leadman. In order to ensure the accuracy of LAP detection, if the LAP reagents of Beijing Leadman are used, we should use dry tube without anticoagulant to collect specimens. If continuing to use heparin lithium-anticoagulant tubes, we should use LAP reagents of Daiichi Pure Chemicals.
亮氨酸氨基肽酶(LAP)广泛分布于人体各组织,以肝、胆、肾、小肠及子宫肌层内含量最多,LAP是用于肝功能检测的指标之一。
在日常工作中,为缩短样本周转时间(TAT)和防止仪器样品针被堵,不少医院使用肝素锂或肝素钠抗凝管采集常规生化项目血样本。我们也在工作中发现使用北京利德曼生化股份有限公司试剂测定肝素锂抗凝血样本LAP时,许多样本结果出现较大的正偏倚,推测肝素可能对LAP测定有干扰。干扰是指在临床生化中,由于另一成分影响样本的特性,待测一定浓度的被分析物出现有临床意义的偏倚[ 1]。我们选用2个厂家LAP试剂,依据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)EP7-A2文件[ 2]对肝素对LAP测定的干扰进行了评价。
同时分别收集40例患者的不抗凝血和肝素锂抗凝血样本。收集5份不抗凝血样本,LAP浓度分别为20、60、85、200、303 U/L。
日本日立公司7180型全自动生化分析仪。北京利德曼生化股份有限公司生产的LAP试剂(简称利德曼试剂),试剂批号为80324C011。日本第一化学药品株氏会社生产的LAP试剂(简称日本一化试剂),试剂R1批号为801RIF,试剂R2批号为802RIF。江苏万邦生化医疗服务有限公司生产的肝素钠溶液(浓度为6 250 U/mL)。不抗凝管和肝素锂抗凝管由广州阳普医疗用品有限公司生产。
1. 测定原理 利德曼试剂为单试剂,日本一化试剂为双试剂,但两者原理相同,均采用速率法测定。即L-亮氨酸-P-硝基苯胺被样本中的LAP分解,游离出L-亮氨酸-P-硝基胺,在405 nm处检测吸光度变化率, LAP活性与每分钟吸光度变化率成正比,据此可计算出LAP的活性(使用计算因子法)。
2. 干扰分析 分别用利德曼试剂和日本一化试剂同时测定40例患者不抗凝血样本和肝素锂抗凝血样本的LAP,对2种样本的LAP结果进行配对 t检验分析,有差异的结果进行“配对差异”试验(paired-difference experiment),判断肝素是否对LAP试剂测定有干扰。(1)干扰试验的判断标准:本研究基于临床经验和被分析物(LAP)检测试剂盒的分析性能,确定10%为干扰限,即检测结果偏倚>10%为干扰;(2)分析物浓度:干扰至少应该在2种医学决定水平被评估,在本研究中分析物浓度分别在参考值上、下限和接近检测方法的线性范围上限,即在20、60、200 U/L3个水平评估肝素对LAP测定的干扰;(3)干扰物浓度:据EP7-A2文件,疑抗凝剂为干扰物时,血清、血浆和全血中抗凝剂浓度应达到正常剂量的5倍,肝素抗凝剂用量一般为12.5~17.5 U/mL;在干扰实验中,抗凝剂浓度选择为正常下限的5倍即62.5 U/mL;(4)“配对差异”试验:选择LAP浓度为20、60、200 U/L的不抗凝血样本,配制肝素钠贮存液A,浓度为1 250 U/mL。取部分上述不抗凝血样本,分为等量的2份,一份加入肝素钠贮存液A,使肝素钠浓度达到62.5 U/mL,作为测试组;另一份加入等量的生理盐水,作为对照组。在同一分析批内用利德曼试剂测定对照组和测试组,3个浓度水平各重复测定3次。
3. “剂量效应”试验 制备系列干扰物浓度的样本,评价干扰物浓度和干扰程度两者之间的关系。选择LAP浓度为20、60、200 U/L的3份不抗凝血样本。每份样本制备成肝素钠浓度为0、62.5 U/mL的样本,按比例混合配成肝素钠浓度分别为31.250、15.625、46.875 U/mL的样本,在同一分析批内按肝素钠浓度大小用利德曼LAP试剂正序、倒序和正序测定上述3组共15个样本,每个样本测定3次。
4. 肝素干扰LAP测定的浓度范围评价 收集一份LAP浓度为303 U/L的患者样本,用生理盐水稀释成浓度为200、150、100、75 U/L的样本,同时又收集一份LAP浓度为85 U/L的患者样本。配制肝素钠贮存液B,浓度为250 U/mL。取上述5个浓度的样本,分为等量的2份,一份加入肝素钠贮存液B,使肝素钠浓度达到正常抗凝剂用量即12.5 U/mL,作为测试组;另一份加入等量的生理盐水,作为对照组。在同一分析批内分别按LAP浓度的高低用利德曼LAP试剂进行正序、倒序测定2次。
5. 日本一化LAP双试剂和单试剂(由双试剂按比例混合配成)检测结果比较 选取10份中低浓度肝素锂抗凝血样本,用日本一化LAP双试剂和单试剂同时检测,计算检测均值的相对偏倚。
利用SPSS10.0统计软件分别对2个厂家不抗凝血样本和肝素锂抗凝血样本的LAP结果进行配对 t检验分析, P<0.05表示差异有统计学意义。
利德曼试剂检测不抗凝血样本和肝素锂抗凝血样本结果差异有统计学意义( P<0.05),日本一化试剂检测2种样本结果差异无统计学意义( P>0.05)。见 表1。
| 表1 不抗凝样本和肝素锂抗凝样本LAP结果的比较( |
在高浓度LAP下,点估计值( dobs)大于Cut-off 值( dc,1.5 U/L),说明肝素引起LAP测定的偏倚在统计学上有意义;但 dobs小于干扰限( dmax,19 U/L),说明肝素在高浓度LAP下不干扰LAP测定。95%可信区间( CI)上限(13 U/L)小于 dmax,这也提示肝素在高浓度LAP下不干扰LAP测定。
在中、低浓度LAP下, dobs值> dc值, dobs值> dmax,说明肝素在中、低浓度LAP下干扰LAP测定。95% CI下限大大超过 dmax,这也提示肝素在中、低浓度LAP下干扰LAP测定。见 表2。
在中、低浓度LAP下,添加了肝素的样本显现出干扰效应。不同浓度的肝素对高浓度LAP未产生干扰效应。见 表3。
| 表2 浓度水平“配对差异”实验结果(U/L) |
| 表3 肝素钠5个系列浓度下LAP的偏倚 |
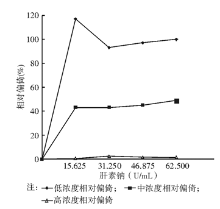
在中、低浓度LAP下,不同的肝素浓度均导致LAP结果的相对偏倚高于10%,提示肝素对此浓度下的LAP测定存在干扰。当肝素的浓度为15.625 U/mL,即达到正常抗凝剂用量时,其干扰效应最大。但是随着肝素浓度的增加,由其引起的干扰并未随之增加,而是呈现不规则的变化。因此可初步判定干扰度与肝素的浓度之间存在非线性函数关系。在高浓度LAP下,不同肝素浓度导致LAP结果的相对偏倚均低于10%,提示肝素对此浓度下的LAP测定不存在干扰。见 图1。
可以初步判定LAP≤97 U/L时,肝素对利德曼试剂产生干扰,在LAP≥149 U/L时,其干扰效应不明显。见 表4。
| 表4 LAP受干扰的浓度范围评估试验结果(U/L) |
日本一化单试剂检测中、低浓度LAP肝素锂抗凝血样本的结果均值(78 U/L)高于双试剂检测结果均值(72 U/L),相对偏倚为8.3%。
对厂商来说,通过EP7-A2文件可以筛选潜在干扰物质,量化干扰效应,证实患者样本中的干扰,确认分析方法对干扰物质的敏感性,评估潜在的风险,并将有意义的干扰声明提供给用户。
对于临床实验室来说,通过EP7-A2文件的调查策略,规定数据收集和分析要求,确认干扰声明,研究明确的干扰物质带来的结果差异,确保分析方法符合临床要求。
在工作中,发现使用利德曼试剂测定肝素锂抗凝血样本LAP时,许多样本测定结果出现较大的正偏倚,推测肝素可能对LAP测定有干扰。预实验曾测定肝素钠抗凝样本和肝素锂抗凝样本的LAP值,结果显示差异无统计学意义( P>0.05),可排除锂离子对LAP测定的干扰。故在本研究中采用肝素钠代替肝素锂进行干扰评价。
为查明肝素是对速率法测定LAP的试剂普遍有干扰还是只对某些厂家的试剂有干扰,本研究采用测定原理相同的日本一化LAP双试剂检测肝素锂抗凝血样本与不抗凝血样本,发现LAP结果差异不具有统计学意义,因而只需对利德曼试剂进行下一步的干扰筛选试验。
干扰筛选试验应该在2种医学决定浓度被评估。若在一种浓度上测试,可能漏过在其他分析物浓度水平上存在的有临床意义的干扰。同时决定一种物质在“最坏情况”的条件下是否会产生干扰,测试还应在在实验室期望观察到的最高浓度水平的患者样本中进行。所以在本研究中选择了参考范围的上、下限及检测范围的上限3个浓度水平。如果只选较高浓度水平样本做干扰筛选试验,可能会得到肝素不是干扰物的结论。
本研究未能找出确切的干扰机制。实验中发现用肝素锂抗凝血浆样本时,利德曼公司LAP试剂反应的线性不好(仪器有报警提示),经过延迟期到监测期时,监测初期斜率明显大于监测中后期。同一患者肝素锂抗凝血浆与干燥管血清的反应曲线相比,初始吸光度值明显偏高,推测肝素在反应过程中起类似加速剂的作用。但对于高浓度样本(LAP≥149 U/L),这种作用不明显,确切机制有待进一步探讨。本研究将日本一化的LAP双试剂配成单试剂进行试验。在中、低浓度LAP下,单试剂测定结果的均值比双试剂测定结果均值高8.3%,推测利德曼LAP试剂如改用双试剂,可能会减少肝素对LAP测定的干扰效应。本研究同时也证明了肝素对这类反应原理相同的LAP试剂不具有普遍性干扰,而是一种较为特殊的干扰现象。
在日常的生化检验工作中会遇到各种干扰因素,从而造成检测结果不准确。要对各种干扰因素进行分析判断及纠正处理,并不是一件容易的事情,必须建立规范而正确的对各干扰因素的分析判断及纠正程序,严格按照程序操作,消除干扰,使检测结果准确可靠[ 3]。
| [1] |
|
| [2] |
|
| [3] |
|