作者简介:刘泽金,男,1974年生,硕士,副主任技师,主要从事生化检验及实验室管理工作。
检测Roche Modular DP全自动生化分析仪(简称Modular DP)的精密度和正确度,以验证Modular DP的检测性能。
方法参考美国临床和实验室标准化协会(CLSI)EP15-A2文件,使用Modular DP及配套原装试剂,检测项目为丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰氨基转移酶(GGT)、乳酸脱氢酶(LDH)、总蛋白(TP)、白蛋白(Alb)、总胆红素(TBil)、直接胆红素(DBil)、血清葡萄糖(Glu)、尿素(Urea)、肌酐(Cr)、尿酸(UA)、三酰甘油(TG)、总胆固醇(TC)、钾(K)、钠(Na)、氯(Cl)、钙(Ca)、镁(Mg)、无机磷(Phos)、肌酸激酶(CK)、α-淀粉酶(Amy)。对所有项目进行精密度验证和正确度验证。
结果所有检测项目2个水平的重复性的标准差(
Modular DP检测项目的重复性、实验室内的精密度和正确度均达到了厂商声明的检测性能,此生化仪的检测性能得到了验证。
To assess the performance of Roche Modular DP automatic biochemical analyzer by detecting its precision and accuracy.
MethodsAccording to EP15-A2 from Clinical and Laboratory Standards Institute (CLSI),23 parameters were measured [alanine aminotransferase(ALT),aspartate aminotransferase(AST),alkaline phosphatase(ALP),gamma-glutamyltransferase (GGT), lactate dehydrogenase(LDH), total protein(TP),albumin(Alb),total bilirubin(TBil),direct bilirubin(DBil),serum glucose(Glu),urea,creatinine(Cr),uric acid (UA),triglycerides(TG),total cholesterol(TC),potassium(K),sodium(Na),chloride(Cl),calcium (Ca),magnesium(Mg),inorganic phosphorus(Phos),creatine kinase(CK),alpha-amylase (Amy)] by Modular DP analyzer and the original reagents. The precisions and accuracies of all parameters were verified.
ResultsIn the 2 levels of tested parameters,the standard deviation of repeatability (
The repeatability, precision and accuracy of the parameters by Modular DP system reach the performance that the manufacturer declares, and the performance of this biochemical analyzer has been verified.
通常一个检测方法应用到临床之前,必须进行三个步骤:首先,实验室必须规定检验方法的性能,检验方法必须达到规定的要求或/及临床有用性;其次,实验室选择厂商声称的检测性能达到了性能规范的方法;再次,检测系统最主要的性能指标是精密度和正确度,必须用实验来验证厂商声称的精密度和偏差是否达到要求。目前美国临床实验室标准化委员会(NCCLS)EP5文件用于检验方法的精密度评价[ 1],EP9文件用于检验方法的比较和偏差估计[ 2]。EP5和EP9常用于检验方法的性能确认,但操作比较麻烦。美国临床实验室标准化协会(CLSI)EP15文件是验证实验室所用检验方法的精密度和正确度是否与厂商的声称一致[ 3],其操作相对简单,对于验证封闭检测系统的精密度和正确度非常方便。目前,这方面的文献报道甚少,我们用CLSI EP15-A2文件来验证Roche Modular DP全自动生化分析仪(简称Modular DP)检测系统的精密度和正确度,以探讨其应用可行性。
仪器为Modular DP。检测项目为丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰氨基转移酶(GGT)、乳酸脱氢酶(LDH)、总蛋白(TP)、白蛋白(Alb)、总胆红素(TBil)、直接胆红素(DBil)、血清葡萄糖(Glu)、尿素(Urea)、肌酐(Cr)、尿酸(UA)、三酰甘油(TG)、总胆固醇(TC)、钾(K)、钠(Na)、氯(Cl)、钙(Ca)、镁(Mg)、无机磷(Phos)、肌酸激酶(CK)、α-淀粉酶(Amy)。所用试剂、校准品及质控品均为Roche公司产品。
在室内质控在控情况下,使用另2个不同水平浓度Roche质控品进行检测,质控品分别为Precinorm U(批号178985)和Precipath U(批号177995)。每天同批检测各水平质控品3次,连续检测5 d,并记录检测数据。如果当天某检测项目室内质控失控或仪器故障则删除数据,重新进行检测。按CLIS EP15-A2文件要求,以重复性(repeatability)代替批内精密度(within-run precision),计算本实验室的标准差( sr )和厂商声明的标准差( σr )。以实验室精密度(within-laboratory precision)代替总精密度(total precision),计算本实验室的标准差( sl )和厂商声明的标准差( σl )。 Xdi为每日检测结果(3次重复),
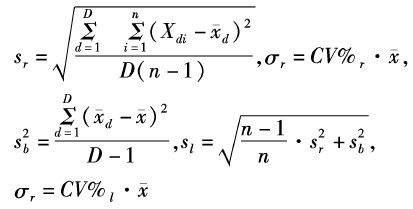
在精密度验证过程中同时进行正确度验证。使用不同于室内质控的2个不同水平浓度 Roche质量控制服务( quality control service, QCS)质控品进行检测,质控品分别为 Precinorm U(批号181528)和 Precipath U(批号180667)。每天同批检测各水平质控品3次,连续检测5 d,并记录检测数据。以2009年6月 Roche Modular DP的全球 QCS同组(使用相同的仪器、试剂和标准品)检测结果均值(数据来源于 Roche诊断公司)作为指定值( assigned values)。计算自由度(3n -1)为14,查表t为2 .624(a为1 %),s为同组的标准差,n为同组的实验室数量,参考以下公式计算验证区间( verification interval, VI)。
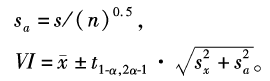
如果Sr≤σr 、Sl ≤σl ,则重复性和实验室精密度与厂商声明的性能一致。如不一致则分别进行验证值计算。重复性的验证值计算公式为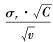 ,自由度v为10,查表 C为20 .48。如Sr ≤σr 验证值,则重复性与厂商的声明一致;实验室精密度的验证值公式为
,自由度v为10,查表 C为20 .48。如Sr ≤σr 验证值,则重复性与厂商的声明一致;实验室精密度的验证值公式为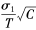 ,查表 C为20 .48,
,查表 C为20 .48,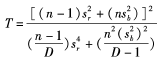 ,如Sl≤σl 验证值则实验室精密度与厂商的声明一致。如果Sr和Sl仍然达不到厂商声明的性能要求,则应重新进行实验,必要时与厂商联系。如果指定值在正确度验证区间内,则本实验室的生化检测正确度与 Roche公司的声明一致,正确度得到了验证;如果指定值超出正确度验证区间,则应重新进行实验,必要时也应与厂商联系。
,如Sl≤σl 验证值则实验室精密度与厂商的声明一致。如果Sr和Sl仍然达不到厂商声明的性能要求,则应重新进行实验,必要时与厂商联系。如果指定值在正确度验证区间内,则本实验室的生化检测正确度与 Roche公司的声明一致,正确度得到了验证;如果指定值超出正确度验证区间,则应重新进行实验,必要时也应与厂商联系。
精密度检测结果见 表1。所有检测项目2个水平的sr≤σr、sl≤σl ,均与厂商声明的精密度性能一致,可以接受。
正确度检测结果见 表2。所有检测项目2个水平的指定值(即 QCS检测均值)均在验证区间内,均与厂商声明的正确度性能一致,可以接受。
| 表1 Modular DP精密度检测结果 |
| 表2 Modular DP正确度检测结果 |
对于厂商的检测系统,只需做基本的性能验证实验[ 4],其中最主要的性能指标是精密度和正确度。 EP5文件程序可用于确认检验方法的精密度,其评价周期较长,操作比较麻烦。 EP15文件程序可用于验证检测系统的精密度,但其前提是检测系统的精密度达到了 CLSI的检测性能。 EP15 -A2为第2版,其中删除了 EP15第1版文件中的3 d检测程序,因为很多检验方法不适合使用。 EP15 -A2文件中精密度验证使用5 d的检测程序。对于正规厂商来说,其声明的精密度应达到了 CLSI的检测性能要求。对2个水平质控物每天测定3次,记录连续5 d的数据,分别计算重复性和实验室精密度的标准差,并与计算的厂商重复性和精密度的标准差对应比较。如果不大于厂商的标准差则精密度与厂商声明的精密度一致,即精密度验证成功;如大于厂商的标准差则计算厂商的标准差验证值,如低于验证值则精密度验证成功。否则应用 EP5文件程序确认精密度。
EP9文件程序用于确认检验方法的正确度,用于确认检验方法(包括封闭系统和非封闭系统)的正确度,其使用患者样本进行方法学比较。如果实验室没有对照方法则不能进行试验。 EP15 -A2规定的正确度验证方法有2种。一种验证方法是用患者样本进行方法学比较,使用分布在测量区间内的20份不同浓度梯度的样本,试验方法与对照检测方法在4 h内完成同一份样本检测,每天检测5 ~7个样本,3 ~4 d完成检测,并计算偏差。如果偏差低于厂商声明的偏差则正确度验证成功。但这种方法也需要对照方法,在同一个实验室内有时不能进行,并且收集不同浓度患者样本比较困难。另一种验证方法是使用有指定值的参考物质,包括4种。法定参考物质( CRMs)可用于正确度验证,但来源困难且费用昂贵;室间质量评价也可用于验证,但存在周期性;厂商的真实度控制品也可验证正确度,但只在厂商内部使用; QCS将室内质控的精密度与实验室间的比对联系在一起,也能用于正确度验证。
QCS是 Roche公司的全球实验室室内质控数据的比对服务,实验室将每月的室内质控数据传至德国 Roche公司,由其计算所有实验室同组检测项目的
本研究数据表明, Modular DP的检测项目重复性和实验室内的精密度均达到了厂商的检测性能声明。另外, Roche公司内部的性能评估报告也同时列出了 CLSI的性能要求,只要达到了 Roche公司的性能要求,也就达到了 CLSI的性能要求。运用 Roche QCS的全球实验室比对数据,评价检验项目的正确度也达到了 EP15 -A2文件的要求。将 Roche全球实验室比对 QCS控制品用于正确度评价取得了满意结果。需要说明的是,使用 QCS不会放大验证区间,这可与美国临床实验室改进法案( CLIA’88)的可接受范围比较得知。
对于自己建立的检验方法(非封闭检测系统)不能使用 EP15 -A2文件,只能使用 EP5和 EP9文件。另外,如果用 EP15 -A2验证达不到厂商声明的性能,则必须用 EP5和 EP9文件程序对检验方法的性能进行确认。
总之,随着检测水平的提高,更多的医学实验室偏重于选择检测系统以保证检测结果的溯源性, EP15 -A2文件程序用于验证检测系统的精密度和正确度,实验周期短并且操作简便,能用于实验室内检测性能验证,还可用于外部质量评价中对不合格项目纠正后的检测性能评价,很适合医学实验室使用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|

