作者简介:秦进,男,1968年生,学士,副主任技师,主要从事分子生物学研究。
探讨蜂毒素对K562 细胞裸鼠移植瘤的生长抑制作用及其与Bax 和Bcl-2表达变化的关系。
方法BALB/C裸鼠皮下接种K562细胞,成瘤后随机分为低(30 μg/kg)、中(60 μg/kg)、高浓度(120 μg/kg)蜂毒素组以及阴性对照组、羟基脲阳性对照组5个实验组。观察各组肿瘤生长情况。采用HE染色光镜和透射电镜方法观察肿瘤细胞的凋亡情况, Western Blot方法观察肿瘤组织中Bax和Bcl-2蛋白表达情况,应用逆转录-聚合酶链反应(RT-PCR)检测肿瘤组织中促凋亡基因(Bax)和B细胞淋巴瘤/白血病-2基因(Bcl-2) mRNA水平。
结果各用药组抑瘤作用与阴性对照组相比差异均有统计学意义(
蜂毒素可以明显抑制K562细胞在裸鼠体内的生长。蜂毒素通过上调Bax的表达、下调Bcl-2的表达,进而促进肿瘤细胞凋亡,这可能是其发挥抗瘤作用的机制之一。
To investigate the growth inhibitory effect of melittin on xenografted human K562 cells in nude mice and its relation with the expression change of Bax and Bcl-2.
MethodsHuman K562 cells were inoculated BALB/C nude mice, and then the tumor-bearing were classified randomly into 5 groups, including low concentration (30μg/kg), middle concentration (60μg/kg) and high concentration (120 μg/kg) melittin groups, negative crontrol group and hydroxy urine group.The growth of xenografted tumors was observed. Apoptosis morphological transformation of K562 cells induced by melittin was detected by HE staining and transmission electronic scan microscope. Apoptosis-related protein levels of Bax and Bcl-2 were determined by Western Blot. The levels of Bax and Bcl-2 mRNA were determined by reverse transcription polymerase chain reaction (RT-PCR).
ResultsCompared to negative control group, all the melittin treatment groups showed having statistical significance (
Melittin suppresses significantly the growth of K562 cells in nude mice. Melittin increases the expression of Bax and decreases the expression of Bcl-2 to induce the apoptosis of K562 cells .This is one of the possible mechanisms of antitumor.
蜂毒素是从传统中药蜂毒中提取出来的,由26个氨基酸组成的一种小分子多肽类生物毒素,氨基酸排列顺序为:甘-异亮-甘-丙-缬-亮-赖-缬-亮-苏-苏-甘-亮-脯-丙-亮-异亮-丝-色-异亮-赖-精-赖-精-谷-谷[ 1]。尽管体外实验已证实其对多种肿瘤有抑制作用[ 2~ 5],但其抗肿瘤的体内实验甚少报道,无法预测体内、外实验可能存在的差异,而影响其临床应用。其中,蜂毒素对常见的白血病细胞模型K562的体内抑制作用至今未见报道。因此,我们旨在通过建立白血病细胞K562的裸鼠皮下肿瘤模型,在体内观察不同剂量的蜂毒素对慢性粒细胞生长的影响并探讨其作用机制,从而为蜂毒素的临床开发与合理应用奠定基础。
BALB/C裸鼠30只(雌性,4~6周龄,体重15~21 g)、K562细胞株、羟基脲及蜂毒素(Sigma),总RNA提取和逆转录试剂盒(上海生工),蛋白预染分子量标准(大连宝生物公司),聚偏氟乙烯(PVDF)膜(美国Bio-Rad公司),兔抗人促凋亡基因(Bax)、B细胞淋巴瘤/白血病-2基因(Bcl-2)单克隆抗体(美国Santa Cruz公司),免疫组化及化学发光试剂盒(武汉博士德公司)。
取对数生长期的K562细胞用PBS稀释成5×107的单细胞悬液,每只裸鼠前肢腋下接种0.2 mL,接种完毕后待瘤体直径至0.5 cm时开始用药。
30只BALB/c裸鼠随机分为5组,分别为阴性对照组[含1%二甲亚砜(DMSO)的0.9%氯化钠溶液],低(30 μg/kg)、中(60 μg/kg)、高浓度(120 μg/kg)蜂毒素组,羟基脲阳性对照组(120 μg/kg羟基脲)。每天1次腹腔给药,连续12 d。
每2天用游标卡尺测量1次肿瘤的长短径计算肿瘤体积,肿瘤体积计算公式:V(mm3)=0.5×长径(mm)×短径(mm)2。用药结束后第2天处死裸鼠,计算抑瘤率。抑瘤率=(阴性对照组平均瘤重-给药组平均瘤重)/阴性对照组平均瘤重×100%。
取瘤组织4%多聚甲醛固定,常规脱水,石蜡包埋后,4 μm切片,HE染色在光学显微镜下进行组织学观察。
取1 mm3大小的肿瘤组织2~3块, 2.5%戊二醛溶液固定4 h后1% 锇酸固定2 h,梯度脱水,环氧树脂渗透包埋,0.5 μm切片,醋酸双氧铀-柠檬酸铅双重染色,透射电镜观察并拍照,对肿瘤细胞凋亡做定性分析。
采用免疫组化(SABC)法检测裸鼠皮下移植瘤Bax及Bcl-2的表达。一抗为链霉蛋白酶标记的鼠抗人Bax及Bcl-2单克隆抗体,二抗用生物素标记的兔抗鼠IgG, Bax、Bcl-2抗体工作浓度均为1∶100,免疫组化操作严格按照试剂盒说明书进行,PBS代替一抗作为阴性对照,已知强阳性石蜡切片作阳性对照。结果判断以细胞胞浆出现棕黄色颗粒为阳性细胞, <5%为阴性(-),6%~25%为阳性(+),26%~50%为中度阳性(++),>50%为高度阳性(+++)。
用Trizol裂解瘤组织提取瘤组织总RNA,逆转录合成cDNA,然后PCR扩增,引物序列及主要反应参数为:Bax的上游引物为5'- AGC TCT GAG CAG ATC ATG AAG AC -3',下游引物为5'- AGT TGA AGT TGC CGT CAG AAA AC -3';Bcl-2上游引物为5'-GAT TGT GGC CTT CTT TGA GTT C-3',下游引物为5'-ACT GAG CAG AGT CTT CAG AGA CA-3';β-actin的上游引物为5'-ACC CCC ACT GAA AAA GAT GA-3',下游引物为5'-ATC TTC AAA CCT CCA TGA TG-3'。RT-PCR反应条件:(1) cDNA合成和预变性:42 ℃ 50 min,94℃ 3 min;(2) PCR扩增:94 ℃ 50 s,55 ℃ 50 s,72 ℃ 90 s,30个循环;(3)延伸:72 ℃延伸5 min。扩增产物经15 g/L的琼脂糖凝胶电泳后,在凝胶成像仪上成像,分析条带的亮度。
称取100 mg新鲜肿瘤组织,提取蛋白质,进行十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶电泳(60 V 30 min,150 V 2 h)。电转移法将蛋白从凝胶中转移到PVDF膜上,用5%脱脂奶粉封闭过夜。一抗兔抗人Bax 和 Bcl-2多克隆抗体10 mL(1∶1 000稀释)室温孵育2 h,HPR-二抗鼠抗兔多克隆抗体10 mL(1∶5 000稀释)室温孵育2 h后,PVDF膜用ECL化学发光试剂盒处理并显影,检测阳性蛋白的表达。
数据用SPSS13.0统计软件进行处理,计量资料用
K562细胞接种后15 d左右开始摸到肿瘤结节,30只裸鼠成瘤率100%。治疗前各组肿瘤平均体积差异无统计学意义( P>0.05),治疗后阴性对照组肿瘤体积增长较快,其余各组肿瘤生长均受到不同程度的抑制。5个实验组间的比较见 表1。各用药组比阴性对照组有明显的抑瘤效应( P<0.05),高浓度蜂毒素组与羟基尿阳性对照组具有同等的抑瘤效应( P>0.05)。
1. 阴性对照组 细胞核大胞质少,排列整齐,瘤细胞生长活跃,核分裂多,瘤细胞异型性大。见 图1(a)。
2. 蜂毒素组 低浓度蜂毒素组肿瘤细胞体积缩小核分裂可见,出血坏死较对照组明显增多,有较多肿瘤细胞凋亡[见 图1(b)];中、高浓度组肿瘤细胞体积明显变小偶见核分裂像,瘤组织中大面积的凋亡区,淋巴细胞浸润,癌细胞核深染,固缩[见 图1(c)、(d)]。
3. 羟基脲阳性对照组 肿瘤细胞体积明显变小,极少见核分裂,瘤组织见广泛的出血坏死现象。见 图1(e)。
| 表1 蜂毒素对人K562细胞裸鼠皮下移植瘤的生长抑制作用( |
1. 阴性对照组 细胞结构清晰,核膜薄而完整,核仁明显,细胞器丰富,线粒体结构存在,表明瘤细胞生长活跃。见 图2(a)。
2. 蜂毒素组 随着蜂毒素浓度的增加,更多的细胞出现凋亡;瘤细胞固缩,核膜凹陷或消失,部分核结构不清;异染色质凝集,边聚逐渐明显;有的形成典型的凋亡小体,细胞器减少,线粒体肿胀受损严重。部分空泡化,部分胞质内可见电子致密颗粒。见 图2(b)~(d)。
3. 羟基脲阳性对照组 细胞微绒毛减少或消失,线粒体等细胞器结构不清,部分细胞核固缩或溶解,表明瘤细胞活性降低。 图2(e)。
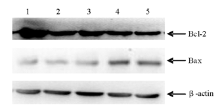
蜂毒素各组随着药物浓度的增加,肿瘤细胞中Bax mRNA的表达逐渐增加,Bcl-2 mRNA的表达逐渐降低。见 图3。以内参照β-actin校正,以校正值作为基因的表达丰度。Bax mRNA和Bcl-2 mRNA的表达丰度均成剂量-反应关系,且均与阴性对照组差异有统计学意义( P<0.05)。见 表3。
| 表3 蜂毒素对K562细胞裸鼠移植瘤组织Bax、Bcl-2表达的影响 |
蜂毒素是蜂毒的主要活性成分, 许多研究表明蜂毒素在体外对恶性肿瘤细胞具有显著的抑瘤作用[ 2~ 5]。但其对慢性粒细胞白血病K562细胞的作用及机制目前仍不清楚,因此探讨蜂毒素对K562细胞诱导作用及其机制对蜂毒素的临床开发及应用具有重要的意义。
细胞凋亡是受基因调控的一种程序性死亡。对维持机体正常平衡起着至关重要的作用。许多抗肿瘤药物均是通过诱导凋亡而实现抑瘤效应的。线粒体连接着若干个凋亡途径, 在凋亡中扮演着重要的角色。线粒体膜电位的丧失是线粒体被激活的显著特征之一。线粒体的跨膜电位下降被认为是细胞凋亡级联反应过程中最早发生的事件, 线粒体的膜电位一旦崩溃则细胞的凋亡将不可逆转。在细胞信号传导的调控中,Bcl-2 家族蛋白和基因在线粒体参与的凋亡途径中起重要的调控作用[ 6]。Bcl-2 家族成员中的蛋白分为抗凋亡与促凋亡两类,抗凋亡的因子包括Bcl-2 和Bcl-x ;而Bax 、Bad、Bak 和Bid 组成前凋亡成员。凋亡的发生和阻止取决于家族成员的相对比例,并反映其二聚化状态。Bcl-2 的同源二聚体阻止凋亡,而Bax 的同源二聚体产生相反效应,Bcl-2 和Bax 的异源二聚体是没有活性的。细胞中两个蛋白的相对比例决定了反应的本质,在线粒体凋亡途径中,Bax/Bcl-2 比率变化影响线粒体膜的通透性,比值增大使线粒体膜通透性加大,引起细胞色素C 的释放,激活caspase-9,最后激活caspase-3,使细胞发生凋亡[ 7~ 9]。
我们的研究表明大黄素能够剂量依赖性的抑制K562细胞裸鼠移植瘤的生长,其机制可能与上调Bax表达,下调Bcl-2的表达有关。本研究RT-PCR结果与Western Blot结果一致,进一步证明了蜂毒素可能是通过上调Bax的表达、下调Bcl-2的表达来诱导肿瘤细胞凋亡。黄雪强等[ 10] 的实验研究表明蜂毒素诱导人T淋巴细胞白血病细胞凋亡与bcl-2 基因表达明显下降有关。国外亦有研究[ 11]显示蜂毒能够体外抑制白血病U937 细胞增殖并诱导其凋亡,其凋亡诱导作用可能与Bcl-2 的下调和caspase-3 的激活密切相关。但其结果与本研究结果不尽相同,考虑可能是因不同细胞系之间存在着生物特性差异,各基因表达水平不同,对外界刺激引起的反应不同。本研究结果证明蜂毒素可增高Bax/Bcl-2 比例。由此推断其后续的效应可能是促进Bax-Bax 同源二聚体的形成,后者大量定位于线粒体膜,从而诱发线粒体膜电位转换孔开放及线粒体膜电位耗散,诱导K562细胞凋亡。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|