通讯作者:杨晓莉, 联系电话:010-57976749。
作者简介:张丽萍, 女, 1975年生, 学士, 主管技师, 主要从事移植后药物浓度监测及自身免疫性疾病的研究。
对酶增强免疫分析法(EMIT)与微粒子酶联免疫吸附法(MEIA)进行比对实验,评估SYVA Viva-E临床化学分析仪(简称SYVA Viva-E)和Abbott IMX分析仪(简称Abbott IMX) 2种检测系统测定他克莫司(FK506)药物浓度的一致性。
方法将Tac/Csa CONTROL质控品分别用SYVA Viva-E(EMIT)和Abbott IMX(MEIA)进行批内、批间精密度测定。FK506的靶值(检测范围):A1水平为4.3(2.1~6.5)ng/mL、A2水平为8.9(5.3~12.5)ng/mL、A3水平为18.0(14.0~22.0)ng/mL。将158份临床患者样本分为极低浓度(0.1~<2.0 ng/mL)、低浓度(2.0~<8.0 ng/mL)、中浓度(8.0~<14.0 ng/mL)、高浓度(14.0~<20.0 ng/mL)和极高浓度(20.0~24.0 ng/mL)5个组,用SYVA Viva-E和Abbott IMX平行测定FK506浓度,观察2种检测系统测定临床样本的相关性。
结果当FK506浓度处于A1水平时,SYVA Viva-E的批内、批间精密度及检测结果均值均高于Abbott IMX(
应用EMIT检测FK506时,其检测结果略高于MEIA,尤其在低浓度范围更加明显。2种检测系统在检测FK506浓度时可能存在系统偏差。
To evaluate the coincidence of the results of tacrolimus (FK506) concentration determined by enzyme-multiplied immunoassay technique (EMIT) using the SYVA Viva-E clinical biochemical analyzer (SYVA Viva-E) and by microparticle enzyme immunoassay (MEIA) using the Abbott IMX analyzer (Abbott IMX).
MethodsThe within-run and between-run precisions were detected with quality control material Tac/Csa by SYVA Viva-E (EMIT) and by Abbott IMX (MEIA). The FK506 target values as determination range were A1=4.3(2.1-6.5)ng/mL, A2=8.9(5.3-12.5) ng/mL and A3=18.0(14.0-22.0) ng/mL. 158 clinical samples were collected as clinical sample group and were classified into 5 concentration groups: extremely low concentration (0.1-<2.0 ng/mL), low concentration (2.0-<8.0 ng/mL), middle concentration (8.0-<14.0 ng/mL), high concentration (14.0-<20.0 ng/mL) and extremely high concentration (20.0-24.0 ng/mL). SYVA Viva-E and Abbott IMX were used to determine the FK506 concentration of equal rank. The correlation of the 2 analyzers detecting clinical samples was observed.
ResultsIn the A1 concentration range, the within-run and between-run precisions and the average results by SYVA Viva-E were both higher than those by Abbott IMX (
The FK506 result by EMIT is slightly higher than that by MEIA, especially in the low concentration range. The FK506 results by 2 detection systems possibly have system error.
他克莫司(tacrolimus FK506),其商品名又称普乐可复(pullock rcusable),是一种大环内酯类强效免疫抑制剂,因其副作用小、抑制作用强、低死亡率、高移植存活率等优点,在临床器官移植的抗排斥作用中应用日趋广泛[ 1]。但FK506治疗窗窄,而且个体差异较大,浓度过高易致肾毒性和高血糖发生,过低又易并发急性排斥反应[ 2]。所以器官移植术后定期监测FK506药物浓度并及时调整用药剂量,对充分发挥FK506的免疫抑制作用,避免或减少不良反应非常重要。国内临床上常用Abbott IMX分析仪(简称Abbott IMX)检测FK506、西罗莫司等药物浓度,以前的检测方法多为微粒子酶联免疫吸附法(microparticles enzyme immunoassay, MEIA)。关于Abbott IMX方法学评价的报道也较多。但随着Abbott IMX分析仪退出市场,寻找一种结果可靠、操作简便,与Abbott IMX结果相关性好的替代仪器,也成为现在Abbott IMX用户的当务之急。西门子公司的SYVA Viva-E临床化学分析仪(简称SYVA Viva-E)运用酶增强免疫分析法(enzyme-multiplied immunoassay tecbniquem,EMIT)检测FK506浓度,因其自动化程度高、样本用量少,样本预处理简单、快速,并且适用急诊和大样本分析测定等优点,现国内应用较多。我们通过2种检测系统测定质控品的精密度及临床样本的对比分析,评估2种检测系统测定FK506药物浓度的一致性。
1.SYVA Viva-E 由西门子公司生产,采用EMIT检测全血FK506浓度。8R109UL Emit®R2000 FK506定标液、8R079UL Emit®R2000 FK506样本前处理试剂、Tac/Csa CONTROL多水平全血质控品及甲醇(美国化学学会试剂,HPLC级)均由西门子医学诊断产品(上海)有限公司提供。
2.Abbott IMX 由Abbott公司生产,采用MEIA检测全血FK506浓度。FK506校标液、质控品、Mode1、沉淀剂均为美国Abbott制药公司产品。
3.其他 VORTEX5振荡仪为江苏海门市其林贝尔仪器制造有限公司产品;Centrifuge 5424D台式离心机为德国Eppendorf公司产品。
1.试剂 SYVA Viva-E检测试剂盒批号为8R019UL-B2。Abbott IMX检测试剂盒批号为69626M100。
2.质控品 由MORE DIAGNOSTICS提供的Tac/Csa CONTROL质控品(批号5255)FK506靶值(检测范围):A1水平为4.3(2.1~6.5) ng/mL;A2水平为8.9(5.3 ~ 12.5) ng/mL;A3水平为18.0(14.0~22.0) ng/mL。
3.临床样本筛选标准 选择2009年1月10日至1月30日之间行肝或肾移植术后的临床患者样本,或者为肝、肾移植术后3个月以上门诊随访患者的临床样本。样本需在服药前采集,检测结果为药物谷浓度。采用EDTA-K2抗凝,无凝集现象。样本采集后,即刻用Abbott IMX分析仪检测FK506,在室内质控在控情况下,选取检测结果最低值为≥0.1 ng/mL、最高值为≤24.0 ng/mL的临床样本。共入选临床样本158份。
5.临床样本分组 根据Abbott IMX检测结果,将FK506浓度为0.1~<2.0 ng/mL的32例样本设为极低浓度组;2.0~<8.0 ng/mL的34例样本设为低浓度组;8.0~<14.0 ng/mL的30例样本设为中浓度组,14.0~<20.0 ng/mL的32例样本设为高浓度组,20.0~24.0 ng/mL的30例样本设为极高浓度组。
严格按照SYVA Viva-E试剂说明书和Abbott IMX试剂说明书对质控品和临床样本进行样本前处理和检测。
1.SYVA Viva-E批内精密度( CV)测定 取A1水平的质控品前处理4次。将上清液倒入同一试管中,充分混匀,用SYVA Viva-E连续检测15次,计算批内 CV。按同样方法检测A2和A3水平的质控品,记录并计算其批内 CV。
2.Abbott IMX批内 CV测定 把A1水平的质控品前处理15次。离心后取上清液倒入同一试管中,充分混匀后,再分别放在15个Abbott IMX专用纤维杯中,用Abbott IMX连续检测15次,计算其批内 CV。按同样方法检测A2和A3水平的质控品,记录并计算其批内 CV。
3.批间(日间) CV测定 每天上、下午分别用SYVA Viva-E和Abbott IMX平行复管检测1次A1、A2、A3水平的质控品,连续检测5 d,计算SYVA Viva-E和Abbott IMX检测的批间 CV。
4.临床样本测定 将Abbott IMX检测后符合入选标准的血样即刻用SYVA Viva-E做平行检测,对照Abbott IMX和SYVA Viva-E检测结果,观察各组检测结果的差异,计算及比较各组的相关系数( r)及总的 r值。
当FK506处于质控品A1水平(即4.3 ng/mL左右)时,2种检测系统的批内、批间 CV差异均有统计学意义( P<0.05),SYVA Viva-E的检测结果均值比Abbott IMX高约1.0 ng/mL。当FK506处与质控品A2、A3相同水平(即8.9~18.0 ng/mL)时,2种检测系统之间的批内、批间 CV相近,二者比较差异无统计学意义( P> 0.05);并且SYVA Viva-E和Abbott IMX的结果均在靶值附近。见 表1。
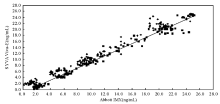
当样本浓度范围处于极低浓度和低浓度水平时(即< 8.0 ng/mL),SYVA Viva-E 检测结果的均值比Abbott IMX高约1.0 ng/mL,二者比较差异有统计学意义( P<0.01),与测定质控品得出的结果一致。当样本浓度处于中浓度以上范围时(即≥ 8.0 ng/mL),SYVA Viva-E检测结果的均值与Abbott IMX相近,二者比较差异无统计学意义( P> 0.05)。见 表2。158份临床样本结果的总体相关性较好( r=0.977),见 图1。
| 表1 SYVA Viva-E和Abbott IMX批内、批间精密度比较 |
| 表2 SYVA Viva-E和Abbott IMX检测临床患者样本组结果的比较 |
目前,FK506浓度检测方法主要有酶联免疫吸附法(ELISA)、MEIA、高压液相色谱法(HPLC)、高效液相串联质谱法(HPLC/MS)和EMIT等[ 3]。国内常用Abbott IMX检测FK506浓度,其测定原理是将样本中FK506作为抗原,与试剂中带有抗体的微粒体结合,再和带有碱性磷酸酶的抗体结合,形成抗体-抗原-碱性磷酸酶复合物。该复合物上的碱性磷酸酶能使无荧光的4-甲基伞花基磷酸酯(MUP)水解成有荧光的4-甲基伞形酮(UP),从而根据所测荧光强度的变化率计算FK506的浓度。随着Abbott IMX退出市场,应用EMIT的SYVA Viva-E正逐渐被临床接受并应用,SYVA Viva-E的检测原理是将样本中FK506与酶试剂中标记有重组酶葡萄糖-6-磷酸脱氢酶(rG6PDH)的他克莫司竞争,活性(游离)的rG6PDH将抗体试剂中的氧化型烟酞胺腺嘌呤二核苷酸(NADPH)转化为还原型烟酞胺腺嘌呤二核苷酸(NAD),致使动态吸光度改变,计算出FK506的浓度。
国外有关于MEIA与EMIT的对比研究报道认为2种方法所测得结果相似,可相互替代,但EMIT在检测数量和检测时间上更优于MEIA[ 4]。国内实验室的水平与国外相比可能会有一些的差异,所以国外的试验研究成果是否适用于国内还需国内实验室再研究、试验。本研究就常用的MEIA与EMIT进行检测结果的比对研究,比较在国内实验室环境下,不同检测系统、检测方法检测FK506浓度的相关性。
由MORE DAGNOSTICS提供的Tac/Csa CONTROL质控品共有4个浓度水平。由于器官移植术后及术后3个月以上的患者FK506药物浓度常处于低、中浓度范围[ 5],故只选用前3个浓度水平进行试验。为了使临床患者的结果可以验证质控品的结论,临床样本组的浓度分组标准基本按照质控品浓度分组,并且分组更细化。在对2种检测系统精密度测定及临床样本比对试验中,SYVA Viva-E所用的试剂是同一盒,试剂开盖稳定时间为12周;Abbott IMX所用的是同一批号的2盒试剂,试剂均在有效期内。
本研究显示质控品在A2、A3水平时,2种检测仪器批内、批间精密度相近。临床患者样本浓度≥8.0 ng/mL 时,SYVA Viva-E的检测结果与Abbott IMX相近,但 SYVA Viva-E的结果均略高于Abbott IMX。当FK506处于低浓度水平时,即临床患者样本检测浓度为2.0~<8.0 ng/mL时, SYVA Viva-E的检测结果比 Abbott IMX高大约1.0 ng/mL,二者差异有统计学意义( P<0.01)。当FK506处于极低浓度(0.1~<2.0 ng/mL)时,SYVA Viva-E与Abbott IMX的检测结果相关性较差( r=0.537)。在SYVA Viva-E检测试剂说明书中明确提到,该仪器检测FK506的分析灵敏度为2.0 ng/mL,在2.0~30.0 ng/mL范围内呈线性关系。所以在实际工作中,当SYVA Viva-E的检测结果≤2.0 ng/mL时,建议该检测结果仅作参考,并持续动态监测该患者的FK506浓度。从总体水平来看,虽然2种检测系统的总体相关性非常好,但SYVA Viva-E的检测结果均略高于Abbott IMX,说明2种检测系统之间可能存在系统偏差。
Abbott IMX与SYVA Viva-E的检测结果有差异,一方面与2种仪器的检测原理有关,虽然2种检测系统均以样本中的FK506作为抗原,但检测方法不同。Abbott IMX是根据抗原抗体结合后所产生的荧光强度计算FK506浓度;而SYVA Viva-E是根据抗原抗体结合后酶活性的多少计算FK506浓度。另一方面,当样本中某些物质具有与待测药物相同的抗原表面标志时,可导致抗体与那些化学结构相近于母体的代谢产物、样本中的内源性物质产生交叉反应,其结果也会出现偏差[ 6]。最后,2种系统间的偏差不能排除环境因素的影响。国内有研究报道[ 7],运用EMIT检测FK506浓度时,实验室环境温度对测定结果的影响非常显著。当定标温度与检测样本温度相差2 ℃以上,测定结果有明显差异,虽然本研究中以室内质控严格筛选临床样本,并严密监测室温,但仍不能避免环境温度有轻微的变化。
总之,SYVA Viva-E (EMIT)和Abbott IMX (MEIA)检测全血FK506浓度时,结果总体相关性良好,但两者之间存在差异,尤其在低浓度时更加明显。检测FK506浓度的金标准为HPLC法,因目前没有条件做进一步的研究,所以这2种检测方法那一种更接近真值还有待于继续研究。我们建议当临床实验室用SYVA Viva-E替代Abbott IMX检测FK506时,≤2.0 ng/mL时的检测结果仅供参考。尤其是门诊随诊患者在动态监测FK506浓度时,临床医生或患者应尽量选择在同一实验室、同一检测系统上进行监测,并且不以1次的检测结果作为临床调药的依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|