作者简介:王庆忠,男,1969年生,博士,主要从事微生物检验及分子诊断研究。
近几周来,因受肠出血性大肠埃希菌感染引发的溶血性尿毒综合征在欧洲多国陆续暴发,死亡人数超过预期,造成了人群极大恐慌,对欧盟经济,特别是农业生产带来了巨大损失。本中心就该疾病的背景、疫情监测和报告、样本采样和送检、检测流程和医院感染控制进行了资料摘编,以供临床防治疫情参考。
肠出血性大肠埃希菌(EHEC)是大肠埃希菌的一种,因其能产生志贺样毒素而具有较强的致病性。感染到发病的潜伏期为3~8 d,平均为3~4 d。临床表现主要有腹部绞痛和腹泻,一些病例为血便样腹泻。多数患者10 d内康复,少数患者特别是幼儿和老年人,可出现严重并发症,如以急性肾功能衰竭、溶血性贫血和血小板减少为特点的溶血尿毒综合症(HUS)。一旦发生HUS,病死率将显著增高。
肠出血性大肠埃希菌主要寄生在牛、羊等家畜和其他反刍动物体内。人类主要通过食用被人畜粪便污染的食物,如未经烹调或烹煮不彻底的肉馅制品或未经消毒的牛奶等被感染。受人畜粪便污染的水、蔬菜等农产品也可导致人的感染。食物制备不当,可导致该病菌的交叉污染[ 1]。
今年4月以来,德国出现肠出血性大肠埃希菌感染暴发疫情。世界卫生组织6月11日报告显示,德国共计有3 147人感染肠出血性大肠埃希菌,在德国以外的地区,有15个国家的108人因感染肠出血性大肠埃希菌患病。欧洲总计有35例患者死亡,700多例患者仍在重症监护室接受24 h监护。经德国卫生部门初步调查,该病菌主要通过被污染的食物传播,一般不发生人与人之间直接接触传播,但已出现粪-口途径传播病例。德国北威州消费者保护部10日宣布,下萨克森州比嫩比尔特的一家农场生产的芽苗菜是这次疫情传染源头,这家农场已经完全查封[ 2, 3]。
既往引起疫情大暴发的EHEC O157∶H7菌株通常携带有志贺毒素1和志贺毒素2(或志贺毒素2及其变种)、LEE毒力岛及携带肠溶血素的大质粒pO157。而根据德国科学家的研究结果,引起此次德国EHEC暴发的O104∶H4菌株除血清型与O157∶H7存在差异外,在毒力基因方面也存在很大差异,二者都携带与出血性肠炎和HUS有关的志贺毒素2,但EHEC O104∶H4不携带LEE毒力岛上的eaeA及pO157大质粒上的ehxA基因,却携带通常在肠集聚黏附性大肠埃希菌(EaggEC)中存在的毒力质粒相关基因。基因组测序的初步结果显示该菌株与2002年从中非艾滋病患者腹泻样本中分离的肠集聚黏附性大肠埃希菌55989菌株的同源性超过93%。EHEC O104∶H4对头孢类、氨基糖甙类、大环内酯类及磺胺类等抗菌药物存在耐药。根据基因组的测序结果,科研人员已经找到了氨基糖甙类、大环内酯类、磺胺类、头孢菌素、单酰胺菌素、青霉素和链霉素类抗菌药物的抗性基因[ 2~ 4]。
因此可以认为,此次德国疫情的EHEC O104∶H4菌株与以往发现的EHEC都不一样,是一种新发现的具有强毒力的大肠埃希菌新变种。这种病菌结合了肠出血性大肠埃希菌和肠聚集性大肠埃希菌的基因特性,因此具有更大危害性。
各级医疗机构发现急性血样便腹泻、腹痛病例,或有急性肾功能衰竭、溶血性贫血、血小板减少等溶血性尿毒综合征临床表现的病例,应询问近期有无赴德国或其周边国家的旅行史。一旦发现有上述临床表现且有旅行史的患者,应立即报告当地疾控机构,并留取粪便及其他相关样本以备检测。疾控机构在核实病例信息后,要立即报告当地卫生行政部门和上级疾控机构,并开展实验室检测。如无相应检测试剂的,可送上级疾控机构检测。有关病例报告和样本采样检测工作可暂参照《肠出血性大肠埃希菌O157∶H7感染性腹泻监测方案》(2005)。肠出血性大肠埃希菌O104阳性样本,须送中国疾病预防控制中心复核确认[ 3, 5]。
1. 患者粪便样本采集,以采集腹泻患者血性水样便为主。可用无菌棉拭采集新鲜血性大便,亦可用棉拭子插入直肠内3~5 cm处采集。肛拭样本应染有粪便。水样便要采集1~3 mL,成形便要采集相当于拇指末节大小的粪量。
2. 腹泻患者血性水样便样本从采集到送检不得超过24 h,采集的样本应插入卡里-布莱尔半固体保存培养基中,立即送实验室接种于培养基。培养基要定期调换,保持培养液新鲜。
3. 水、食品、环境样本采集后,应在24 h内送至实验室进行增菌、培养、分离。
4. 样本检验单应填写完整,与样本一起送实验室。必须提供与分离菌株相对应的患者的临床资料和流行病学资料。
5. 使用免疫磁珠富集技术和山梨醇麦康凯琼脂或科玛嘉琼脂分离肠出血性大肠埃希菌O104∶H4;按照山梨醇不发酵、O104∶H4特异性血清初筛、生化反应鉴定和聚合酶链反应(PCR)鉴定的程序进行肠出血性大肠埃希菌O104∶H4 的初筛和鉴定;初筛阳性的菌落和可疑菌落应保存下来, 交疾控机构进行分子生物学鉴定和分型。
1. 经过分纯的没有污染的菌株;分离菌株应该用甘油半固体保存。
2. 与分离菌株相对应的患者的临床症状和流行病学资料。
3. 当地的肠出血性大肠埃希菌O104∶H4 或EHEC 的分离率资料。。
在临床实际工作中,通过采用EC 肉汤增菌、免疫磁珠吸附法集菌、CHROMAGAR显色培养基分离的技术程序,可以提高大肠埃希菌O104∶H4 检出率。挑选在山梨醇麦康凯琼脂上山梨醇不发酵、血清分型为O104∶H4、CHROMAGAR显色培养基及生化试验符合大肠埃希菌的分离株。采用PCR方发检测stx1和stx2基因,如stx1和/或stx2阳性,用PCR 方法继续检测eaeA、ehxA、aggR、wzy、fliC等毒性基因,以确定分离菌株的毒力特性。检测流程见 图1。
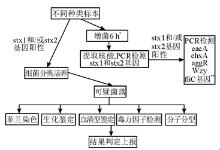 | 图1 肠出血性大肠埃希菌O104∶H4检测技术流程[ 1] |
9个毒力基因/抗原特异基因PCR检测的引物和扩增目的片段长度见 表1,其中针对EHEC的4个基因——stx1、stx2、eaeA和ehxA;针对肠积聚性黏附大肠埃希菌毒力质粒上的3个基因——aatA、aggR、aap;以及O104特异基因wzy和H4特异基因fliC。wzyPCR扩增需要采用血清凝集试验确认,而fliC基因PCR扩增阳性,需要进行产物测序和/或血清凝集试验确认。
| 表1 毒力基因/抗原特异基因PCR检测的引物和扩增目的片段长度 |
根据德国学者Bill Marler教授研究,肠出血性大场埃希菌O104∶H4的生物学特性如下:
1.毒力基因 Stx 1:-(阴性), Stx 2 (vtx2a): + (阳性), eae:-(阴性), hly:-(阴性)。
2.MLST序列型 ST678(adk 6,fumC6,gyrB 5,icd 136,mdh 9,purA 7,recA 7)。
3.抗菌药物耐药情况 见 表2。
| 表2 肠出血性大肠埃希菌O104∶H4抗菌药物耐受情况简表 |
肠出血性大肠埃希菌感染疫情多属食源性疾病暴发,一般无须对患者进行隔离。但肠出血性大肠埃希菌易引起感染。因此,各级医疗卫生机构要切实做好患者及密切接触者的健康教育,要求其注意个人卫生尤其是手部卫生;要做好患者排泄物的消毒处理和环境卫生消毒工作,防止发生院内感染。
具体检测技术流程以及毒力基因、抗原特异性基因PCR检测引物和MLST/PFGE分子分型方法参见文献[ 5]。
致谢:感谢倪语星、赵虎、张珏等专家对本文撰写提供的帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|

