作者简介:徐翀,男,1971年生,学士,副主任技师,主要从事免疫学工作。
观察儿童急性淋巴细胞白血病中肝癌缺失-1(DLC-1)抑癌基因启动子甲基化状态,评估该基因甲基化对于急性B淋巴细胞白血病(B-ALL)的预后价值。
方法对40例B-ALL患儿DLC-1启动子甲基化状态与白血病敏感预后指标白血病微小残留病灶(MRD),以及其他对B-ALL预后可能有影响的指标作一比较,评价DLC-1对于B-ALL的预后判断价值,以及是否可以作为B-ALL的独立预后危险因素。
结果DLC-1甲基化阳性的B-ALL患儿的复发率和5年无事件生存率均与DLC-1甲基化阴性患儿差异有统计学意义(
DLC-1甲基化和MRD都是B-ALL有意义的预后指标,两者结合可为临床提供覆盖面更广的预后信息。DLC-1甲基化也显示了该指标有成为独立预后危险因素的趋势。
To observe the status of the deleted in liver cancer-1 (DLC-1) gene promoter methylation and estimate the prognostic value in patients with childhood B-cell acute lymphoblastic leukemia (B-ALL).
MethodsThe prognostic significance of DLC-1 methylation status in B-ALL was determined by analyzing the associations among DLC-1 methylation status and the sensitive prognostic factor minimal residual disease (MRD) as well as other potential prognostic factors from 40 patients with childhood B-ALL for evaluating whether it could be an independent risk factor.
ResultsThe B-ALL patients with DLC-1 gene methylation had significant different relapse rate and event-free survival rate from those without DLC-1 gene methylation(
Both MRD and DLC-1 gene methylation are good markers for the prognosis of B-ALL. The combination of these 2 markers could provide wider coverage of information for prognosis assessment. DLC-1 gene methylation also shows the trends of being an independent risk factor for the prognosis.
肝癌缺失-1(deleted in liver cancer, DLC-1)基因为抑癌基因之一,其表达可以抑制多种肿瘤的生长[ 1~ 3]。因此,DLC-1基因启动子甲基化可能成为部分白血病的发病机制中的重要因素。也正由于此原因,白血病细胞中DLC-1启动子的甲基化,在甲基化状态未受纠正的情况下,可能影响白血病的预后。白血病微小残留病灶(minimal residual disease, MRD)是迄今预示白血病复发的最敏感的指标,在急性B淋巴细胞白血病(B acute lymphoblastic leukemia, B-ALL)中其有效覆盖率可达91.43%。本研究将DLC-1启动子甲基化与MRD,以及其他对B-ALL预后可能有影响的指标作一比较,评价DLC-1对于B-ALL的预后判断的价值,以及是否可以作为B-ALL的独立预后危险因素。
自2005年3至6月期间在上海儿童医学中心确诊并进入上海儿童医学中心-2005(SCMC-2005)治疗方案的B-ALL患儿40例。其中男、女各20例;中位年龄5.5岁(1.5至16岁)。诊断均经FAB分型法和流式细胞术免疫分型法确诊,并按SCMC-2005危险度分类标准进行分层治疗,其中低危组18例,高危组22例。随访截止时间为2010年6月31日。
1. 细胞形态学检查 初诊患者骨髓细胞形态学检查按FAB分型诊断标准给出诊断意见;诱导缓解治疗期间治疗反应的评判方法和标准见帖利军等[ 4]的方法。
2. 白血病免疫分型 采用流式细胞术按文献[ 5]中的方法进行免疫表型检测。其中,原B急淋(Pro B-ALL) 4例,普通B急淋(Common B-ALL) 22例,前B急淋(Pre B-ALL) 12例,成熟B急淋(Mature B-ALL) 2例。同时,根据是否有CD13和/或CD33表达,分为伴髓系抗原表达(My+B-ALL)和不伴髓系抗原表达(My-B-ALL)。
3. 白血病微小残留监测 按参考文献[ 6]在诱导缓解治疗结束达临床缓解(clinical remission, CR)35d±2d时及以后的持续治疗期间,通过四色流式细胞术进行MRD监测,按结果≥0.01%定义为阳性。
4. DLC-1基因启动子甲基化检测 按参考文献[ 7],初发时患儿的骨髓细胞提取DNA,用甲基化特异性聚合酶链反应(methylmion specific PCR, MSP)检测DLC-1启动子是否存在甲基化,并用焦磷酸测序法进行验证。
无事件生存(events-free survival, EFS)定义为从患者进入本研究开始到任何事件(如复发、死亡和第2肿瘤等)发生。如始终无事件发生或失访,其EFS定义为自进入本研究至最后一次的随访时间。生存分析采用Kaplan-meier法,各组生存率的比较采用long-rank检验,独立预后因素的影响采用COX回归模型分析,以上所有数据均用SPSS13.0系统软件处理。生存曲线图用GraphPad Prism 5.0软件绘制。
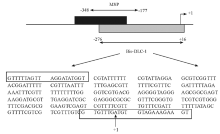
图1显示DLC-1 基因启动子区引物所在位置,MSP 区域位于启动子区-348至-177 位置;焦磷酸测序所用PCR 扩增片段区域位于启动子区-276至+16 位置。采用甲基化引物扩增出的片段为172bp,采用非甲基化引物扩增出的片段为178bp。MSP和焦磷酸测序结果显示40例B-ALL患儿中,DLC-1基因启动子甲基化阳性为15例(37.5%)。DLC-1甲基化与患者年龄、性别、白细胞数、FAB分类、免疫学分型、临床分型等均无显著相关。
以ATG起始密码子为+1,MSP扩增区域为-348至-177;焦磷酸测序所用PCR 扩增片段区域位于启动子区-276至+16,有框的序列为引物区,见 图1。
对初发患儿骨髓标本用多种抗体组合进行有效性筛选,对诱导缓解治疗结束达CR时及以后的持续治疗期间的患儿骨髓标本用有效的抗体组合进行MRD监测。抗体组合见 表1。
| 表1 用于MRD检测的四色抗体组合 |
结果显示,40例B-ALL患儿中,有7例在诱导缓解治疗前的MRD检测抗体组合有效性筛选时,未找到合适的抗体组合用于监测,故共有33例患儿在诱导缓解治疗结束点及以后的持续治疗期间进行了MRD监测,其中出现MRD阳性结果的共18例(54.5%)。其余15例在持续治疗期间一直为阴性结果。
1. DLC-1基因启动子甲基化状态和B-ALL复发率 40例B-ALL患儿中,DLC-1基因启动子甲基化阳性15例,其中在5年随访期间复发9例(60%);甲基化阴性25例,复发6例(24%)。经检验,发现DLC-1启动子甲基化的B-ALL患儿5年内复发率高于甲基化阴性患儿(χ2=5.184, P<0.05),见 表2。
| 表2 DLC-1启动子甲基化与B-ALL复发率的关系 |
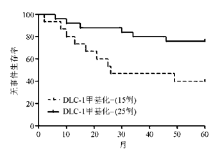
2. DLC-1基因启动子甲基化对B-ALL患儿5年无病生存率的影响 我们对40例研究对象进行了5年的跟踪随访,按5年内有无事件发生统计无事件生存率。DLC-1基因启动子发生甲基化的患儿5年无事件生存率为(43±13)%,未发生甲基化的患儿5年无事件生存率为(72±9)%,两者差异有统计学意义( P<0.05)。DLC-1甲基化状态5年无事件生存曲线图见 图2。
为考察这两种评价指标是否因其结果分布之间的一致性而决定其同时对B-ALL的预后有重要意义,需对这两种指标作一比较,分析两种评价指标的相互关系。
40例B-ALL患儿初发时的骨髓标本都做了DLC-1基因启动子甲基化检测,而其中只有33例经筛选有合适的四色抗体组合用于诱导缓解治疗及以后持续治疗期间的MRD检测。因此,此33例同时具有DLC-1基因启动子甲基化检测结果和MRD监测结果的患儿可用于两种评价指标相互关系的统计检验。采用配对计数资料的 χ2检验,结果见 表3。
应用确切概率计算法检验,χ2=0.002 6,得 P>0.05,按α=0.05水准,不能认为MRD和DLC-1启动子甲基化两个预后评价指标之间相关。但临床资料显示,4例患儿MRD阴性而DLC-1甲基化阳
性,其中1例复发;13例患儿DLC-1甲基化阴性而MRD阳性,复发5例。但两者同为阳性结果的5例患儿在5年内全都复发,复发率为100%;而两者同为阴性结果的11例患儿,仅1例在5年内复发,复发率为9%。
| 表3 MRD和DLC-1启动子甲基化两个预后评价指标之间关系 |
本研究分别分析了性别、年龄、治疗前外周血白细胞数、是否带有髓系标记、是否胞浆表达免疫球蛋白重链μ(cytoplasmic μ, cμ)、MRD以及DLC-1启动子甲基化等因素对患儿5年无事件生存的影响(见 表4)。由于标本采集困难等原因,部分患者未能进行融合基因和染色体检测,而剔除此部分病例又导致统计分析的例数太少,故融合基因和染色体检测结果未在分析之列。
| 表4 各种预后影响因素对5年无事件生存率的影响 |
通过比较多种预后因素对5年无事件生存率的影响,MRD和DLC-1基因启动子甲基化与治疗预后显著相关( P<0.05),而性别、年龄、治疗前外周血白细胞数、是否带有髓系标记以及cμ表达情况对治疗预后无影响( P>0.05)。
经多因素COX回归分析,结果表明在本研究所有涉及的影响因素中仅MRD可作为独立的预后危险因素(见 表5)。MRD阳性患儿的复发风险是MRD阴性者的17.027倍,DLC-1甲基化阳性患儿的复发风险是DLC-1阴性者的8.467倍。
| 表5 各种影响因素的COX回归分析 |
B-ALL在儿童白血病中预后相对较好,一旦复发,特别是骨髓复发,则预后极差[ 8]。因此,基于危险因素分析的治疗,特别是明确患者早期是否具有不利的临床或实验室特征,从而适当地调整治疗方案,使患者得到个体化的治疗,对于提高治疗预后具有重要意义。
现已证实,DLC-1蛋白可通过对RhoGTP的水解作用使活性Rho蛋白变成结合GDP的失活状态而起到抑制Rho蛋白的功能[ 9],因此DLC-1基因现已被证实是一个新的抑癌基因。DLC-1基因启动子甲基化在其他多种实体瘤中较为多见,故该基因表达的减少或缺失在多种肿瘤的形成中起重要作用[ 10~ 13]。我们的研究发现,DLC-1基因启动子甲基化在B-ALL中发生率为37.5%(15/40),并可能在B-ALL的发生机制中起重要作用。而正因为DLC-1基因甲基化可能是肿瘤发生机制中的重要因素,故对于治疗过程中体内仍存在残存白血病细胞的患儿来说,DLC-1基因甲基化阳性和阴性的患者可能具有不同的预后。目前国际上对于DLC-1基因启动子甲基化与儿童期B-ALL的预后关系尚未见报道。本研究对40例B-ALL患儿进行了5年跟踪随访,并结合当前最敏感的白血病预后因素——MRD,评价了DLC-1基因甲基化对于B-ALL的预后作用。
实验结果表明,DLC-1基因甲基化阳性患儿的5年内复发率为60%,高于甲基化阴性的患儿5年内复发率(24%),差异有统计学意义( P<0.05);甲基化阳性患者的5年无事件生存率为(43±13)%,与未发生甲基化的患儿5年无事件生存率(72±9)%,差异有统计学意义( P<0.05)。因此,DLC-1启动子甲基化可能成为B-ALL的一个新的预后指标。
但是,统计结果显示,DLC-1启动子甲基化作为预后指标与MRD的结果分布并不一致( P>0.05)。因此,DLC-1启动子甲基化和MRD可能成为两个互相独立的预后评价指标。临床资料显示,33例B-ALL患儿中,4例患儿MRD阴性而DLC-1甲基化阳性,其中1例复发;13例患儿DLC-1甲基化阴性而MRD阳性,复发5例。两者同为阳性结果的5例患儿在5年内全都复发,复发率为100%;而两者同为阴性结果的11例患儿,仅1例在5年内复发,复发率为9%。结果表明,DLC-1启动子甲基化和MRD两个指标互相协同、补充,可为临床提供覆盖面更广的预后信息,而两者结果相同部分(本研究中同为阳性的患者复发率为100%,同为阴性的患者复发率为9%)则可能显示出比两个单一指标更有意义的预后作用。
在SCMC-2005治疗方案中作为危险度分级标准、与B-ALL预后相关的因素,如性别、年龄、治疗前外周血白细胞数、是否带有髓系标记、是否胞浆表达cμ等在单因素分析和COX回归模型多因素分析中均未显示与B-ALL预后高度相关。仅MRD可作为独立的预后危险因素( P=0.017),MRD阳性患儿5年内复发风险是MRD阴性患儿的17.027倍。而DLC-1甲基化未能成为B-ALL独立预后危险因素,这可能与本研究中病例数有限有关。但多因素COX回归分析结果显示,DLC-1基因甲基化阳性患儿复发风险是甲基化阴性患儿的8.5倍( P=0.057),也显示了该指标有成为独立预后危险因素的趋势,这有待大量病例的研究来进一步证实。因此,DLC-1启动子甲基化可能也成为B-ALL的一个新的独立的预后危险因素。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|