作者简介:丛培珊,女,1984年生,硕士,主要从事临床免疫学研究。
评估人附睾蛋白4(HE4)对子宫内膜癌和卵巢癌的早期辅助诊断价值。
方法采用酶联免疫吸附试验(ELISA)和电化学发光法对47例子宫内膜癌、30例子宫良性疾病、34例卵巢癌、38例卵巢良性肿瘤患者以及30名健康对照者血清HE4、糖类抗原125(CA125)和糖类抗原724(CA724)浓度进行检测分析。
结果早期子宫内膜癌、晚期子宫内膜癌、卵巢癌患者血清HE4水平均高于健康对照(
HE4对早期子宫内膜癌和卵巢癌均具有较高的敏感性,有助于2种癌症的早期辅助诊断。
To evaluate the value of human epididymis protein 4 (HE4) in the early diagnosis of endometrial and ovarian cancers.
MethodsThe serum concentrations of HE4, carbohydrate antigen 125(CA125) and carbohydrate antigen 724 (CA724) in 47 patients with endometrial cancer, 30 patients with benign uterine diseases, 34 patients with ovarian cancer, 38 patients with benign ovarian tumor and 30 healthy controls were determined by enzyme-linked immunosorbent assay (ELISA) and electrochemiluminescence immunoassay.
ResultsThe concentrations of HE4 were significantly higher in patients with early- and late-stage endometrial and ovarian cancers than in healthy controls(
HE4 has a high sensitivity for detecting early-stage endometrial and ovarian cancers, and it is helpful in the early diagnosis of the 2 cancers.
子宫内膜癌和卵巢癌为女性生殖系统常见的恶性肿瘤。糖类抗原125(CA125)作为卵巢癌肿瘤标志物已在临床应用20余年,但其敏感性仅为40%~50%,且在许多良性疾病中也常升高,临床应用价值不甚理想,有待筛选敏感性和特异性更高的肿瘤标志物用于卵巢癌的早期诊断[ 1]。对子宫内膜癌而言,目前临床上尚无广泛应用的肿瘤标志物。人附睾蛋白4(HE4)是近年发现的一种新的有助于卵巢癌和子宫内膜癌诊断的标志物[ 2, 3],但有关HE4对卵巢癌,尤其是对子宫内膜癌辅助诊断价值评估方面的研究甚少。本研究通过分析比较子宫内膜癌、卵巢癌患者血清中HE4以及对卵巢癌有一定辅助诊断价值的CA125和糖类抗原724(CA724)水平,单项和联合检测的敏感性、特异性以及受试者工作特征(ROC)曲线下面积(AUC)等指标的差异,评估HE4对子宫内膜癌和卵巢癌的早期辅助诊断价值。
选择2009年8月至2010年1月因妇科肿瘤在青岛大学医学院附属医院住院拟行手术治疗的患者。根据术后病理报告将患者分为以下4组:(1)子宫良性疾病组30例,年龄28~70岁,平均50.7岁,包括子宫内膜异位症2例、子宫肌瘤23例、子宫内膜单纯性增生3例、子宫腺肌病2例;(2)子宫内膜癌组47例,年龄39~80岁,平均55.8岁,依据国际妇产科联盟(FIGO)2000标准分期,早期(Ⅰ~Ⅱ期)42例、晚期(Ⅲ~Ⅳ期)5例;(3)卵巢良性肿瘤组38例,年龄23~69岁,平均46.5岁,包括卵巢囊肿4例、浆液性囊腺瘤5例、卵泡膜细胞瘤2例、囊性畸胎瘤11例、黏液性囊腺瘤7例、纤维瘤2例、巧克力囊肿4例、中肾管源性囊肿3例;(4)卵巢癌组34例,年龄23~77岁,平均50.9岁,依据FIGO 2000标准分期,早期(Ⅰ~Ⅱ期)22例、晚期(Ⅲ~Ⅳ期)12例。另选择同期健康体检诊断为健康的妇女30名作为健康对照组,年龄22~66岁,平均48.2岁,排除生殖、呼吸、乳腺及内分泌疾病。子宫内膜癌、卵巢癌与健康对照和相应良性疾病组间年龄比较,差异无统计学意义。
清晨用普通真空试管采集所有研究对象(手术患者于术前)空腹静脉血3 mL,室温静置1 h左右,以3 000 r/min(离心半径为14.7cm)离心15 min,分离血清,-40 ℃冰箱冻存待用。
1. 血清CA125、CA724水平测定 采用全自动电化学发光免疫分析系统(cobas e601,瑞士罗氏公司)及其配套的试剂盒测定,严格按照仪器说明书操作。
2. 血清HE4水平测定 采用瑞典康乃格诊断试剂公司生产的酶联免疫吸附试验(ELISA)试剂盒,严格按照说明书操作。
采用SPSS 15.0软件进行统计。呈偏态分布资料用中位数及四分位数表示,多组数据比较用非参数Kruskal-wallis H检验,两两比较用Mann-Whitney U检验。敏感性、特异性的比较采用 χ2检验。各指标的AUC比较用 Z检验。 P<0.05为差异有统计学意义。
早、晚期子宫内膜癌组仅HE4水平明显高于健康对照组( P<0.01)和子宫良性疾病组( P<0.05)。早、晚期卵巢癌组HE4、CA125和CA724水平均明显高于健康对照组( P<0.01)和卵巢良性肿瘤组( P<0.05)。见 表1。
| 表1 各组HE4、CA125、CA724水平的比较[中位数(四分位数)] |
在相同特定特异性下,HE4对早期子宫内膜癌的敏感性较CA125显著升高( P<0.01),且与CA125联合检测不增加HE4的敏感性。但HE4对早期卵巢癌的敏感性与CA125、CA724单项及后两者联合检测比较差异无统计学意义;HE4对早期子宫内膜癌和卵巢癌的敏感性差异无统计学意义。见 表2。
| 表2 相同特定特异性下,HE4、CA125和CA724对早期子宫内膜癌和卵巢癌的敏感性比较(%) |
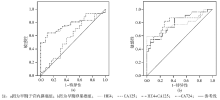
对HE4、CA125和CA724制作ROC曲线并取约登指数最大点处的敏感性和特异性进行分析,如 图1a、 表3所示,早期子宫内膜癌组HE4的AUC明显高于CA125( P<0.01),选取约登指数最大点处HE4的敏感性明显高于CA125,特异性与其相当,HE4与CA125联合检测AUC及敏感性均未见增加;如 图1b、 表4所示,早期卵巢癌组HE4的AUC及约登指数最大点处的敏感性、特异性与CA125、CA724单项及后两者联合检测比较差异均无统计学意义,且对早期子宫内膜癌的敏感性相当。
| 表3 早期子宫内膜癌组HE4和CA125的AUC及约登指数最大点处敏感性、特异性的比较 |
| 表4 早期卵巢癌组HE4、CA125和CA724的AUC及约登指数最大点处敏感性、特异性的比较 |
2003年Hellström等[ 2]首次发现大多数卵巢癌患者血清中HE4水平明显升高,预言该蛋白可能成为卵巢癌新的血清学标志物。近年国外学者相继报道卵巢癌和子宫内膜癌患者血清HE4水平明显升高[ 3, 4]。国内也有学者提出,HE4有助于卵巢癌的辅助诊断和疗效监测[ 5]。但有关HE4作为子宫内膜癌肿瘤标志物的研究国内尚未见报道。
本研究观察到,早、晚期子宫内膜癌、卵巢癌患者血清HE4水平较健康对照组和各自良性疾病对照组均明显升高,且对2种癌症诊断的敏感性均较高,为HE4作为新的子宫内膜癌和卵巢癌标志物提供了新的研究依据,且填补了国内HE4对子宫内膜癌辅助诊断价值的研究空白。我们同时还观察到在相同特异性下,HE4单项检测较其他标志物诊断早期子宫内膜癌敏感性均升高,与CA125或CA724联合检测并不增加该敏感性,表明HE4在早期诊断子宫内膜癌方面有望成为独立的高敏感性的检测指标。而在卵巢癌早期诊断方面,无论以健康组还是以良性疾病组为对照,HE4的敏感性与CA125和CA724比较差异无统计学意义,这与董丽等[ 6]报道以健康组为对照的研究结果相一致,但与其报道的以卵巢良性疾病组为对照,相同特异性下,HE4的敏感性高于CA125的研究结果有差异,分析其原因可能与彼此采用的CA125检测方法以及试剂盒的厂商来源不同有关。董丽测定CA125采用的是ELISA;本试验CA125测定采用的是电化学发光法,该检测方法更精准,敏感性和精确度较ELISA高,可能也是导致CA125的敏感性升高的原因之一。
ROC曲线分析表明,早期子宫内膜癌组HE4的AUC及约登指数最大点处的敏感性均明显高于CA125,与CA125联合检测不增加HE4的AUC和敏感性,表明HE4对早期子宫内膜癌有较好的独立辅助诊断价值。Moore等[ 3]的研究也表明,HE4单项检测对早期子宫内膜癌的敏感性和AUC均高于CA125和CA724,我们的研究结果与其相一致。而对早期卵巢癌患者,HE4的AUC和约登指数最大点处的敏感性与CA125和CA724比较差异无统计学意义,表明HE4对卵巢癌的早期辅助诊断价值与CA125和CA724相当。
另外卢仁泉等[ 5]曾对卵巢癌组患者按经期状态进行分组,但未见报道绝经与未绝经妇女血清HE4水平有明显差异,纵观国内外的有关研究资料,故我们对研究对象未按绝经状态进行分组。
总之,HE4检测为子宫内膜癌和卵巢癌筛查提供了新的血清学诊断指标和依据,有望成为子宫内膜癌和卵巢癌早期筛查的良好指标,但要广泛应用于临床尚需大样本、多中心的临床验证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|