作者简介:张会芬,女,1970年生,学士,主管技师,主要从事临床生物化学检验工作。
对改良的磺基水杨酸-硫酸钠比浊(SS-S)法测定脑脊液蛋白进行评价,选择一种快速、准确、低廉、适合临床常规检验的方法。
方法按美国临床实验室标准化委员会(NCCLS)评价方案进行精密度、线性和干扰试验,并以邻苯三酚红钼络合显色(PRM)法为比较方法,对2种方法进行比较和相关性分析。
结果SS-S法低、高值批内变异系数(
改良的SS-S法简便、快速、准确、低廉、抗干扰性强且样本用量少,适合临床实验室推广使用。
脑脊液蛋白是临床医院常见的检验项目,常用于脑膜炎、脑肿瘤、脑出血、脑外伤等疾病的监测与诊断,具有较重要的临床意义。手工操作磺基水杨酸-硫酸钠比浊(SS-S)法[ 1]是基层医院实验室在较长时间内一直延续使用的传统手工方法,由于操作相对繁琐,人为干扰因素多,大大降低了准确度和精密度。经过一段时间的摸索,我们对其进行了改良,应用SS-S法在全自动生化分析仪上测定脑脊液蛋白,并与邻苯三酚红钼络合显色(PRM)法进行比较分析。
采集华北煤炭医学院附属开滦医院住院患者新鲜脑脊液样本40份,除外溶血样本。
日立7600型全自动生化分析仪。SS-S试剂按《全国临床检验操作规程》(第3版)配置。称取无水硫酸钠(分析纯)7.0 g,磺基水杨酸(分析纯)3.0 g,分别以蒸馏水溶解并稀释至100 mL,作为试剂1(R1)和试剂2 (R2)待用。2种试剂成分均由国药集团化学试剂有限公司提供。校准品、质控品、定值血清和PRM法试剂盒(单试剂,终点法)由北京利德曼生化技术有限公司提供。
SS-S法为双试剂。反应类型为两点终点法,反应时间为10 min,读数点为16~34,主波长为530 nm,副波长为700 nm,样本量为10 μL ,R1量为150 μL,R2量为80 μL,反应方向为正向,校准类型为两点校准。
选用北京利德曼生化技术有限公司提供的1.0 g/L浓度的校准品进行校准(其准确性可溯源到国际临床化学学会标准参考物质CRM470),每天跟随室内质控监测。按美国临床实验室标准化委员会(NCCLS)评价方案进行精密度、线性和干扰试验,并以PRM法为比较方法,对2种方法进行比较和相关性分析。
采用SPSS 11.5软件进行统计,数据以
每天用2种方法分别测定0.75、1.75 g/L的蛋白标准液各2次(2次测定间隔>2 h),每次均做双份测定,连续检测20 d。如果每次双份测定的差值超过初步精密度测定时标准差( s)的5.5倍,这对数据为“离群点”,弃去重做。按照NCCLS评价方案,求出日平均均值、批内变异系数( CV)、批间 CV、日间 CV、总 CV。结果显示对于低值样本PRM法优于SS-S法,高值样本SS-S法优于PRM法。见 表1。
| 表1 2种方法检测脑脊液蛋白精密度对比(%) |
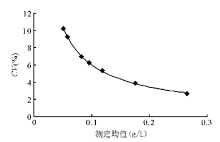
参考《全国临床检验操作规程》(第3版)。应用改良SS-S法测定脑脊液蛋白中标示的线性范围,将中生公司提供的浓度为70 g/L总蛋白定值血清用生理盐水稀释成不同浓度(3.500、2.333、1.556、1.037、0.691、0.307、0.136 g/L),随机排列,分别连续测定4次,当日完成,试验中未发现“离群点”。取平均值为测定值( Y),与理论值( X)进行线性评价。PRM法回归方程为 Y=1 .029 X-0 .014 7, r=0.999 0;SS-S法回归方程为 Y=0 .980 1 X-0 .011 4, r=0.997 7。经线性失拟检查,2.333 g/L 为最高检测值,且2种方法在0.136~2.333 g/L之间线性良好。
选择不同浓度(0.265 3、0.174 8、0.118 0、0.096 0、0.082 0、0.058 0、0.051 0 g/L)的低值血清7份,每天各测1次,共10 d,分别计算
取定值(2.0 g/L)血清按1∶2、1∶5、1∶10、1∶20稀释,用改良SS-S法分别检测3次,求均值,计算理论值与测定值的比值[R(%)]。当1∶20稀释时,R(%)<80%,证明本法检测的最大稀释度只能为1∶10。SS-S法临床可报告范围为0.053~2.333 g/L。
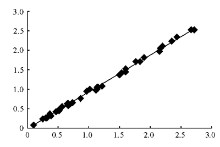
留取住院患者新鲜脑脊液样本40份,每天测5份,共测8 d。用2种方法分别作双份测定,第1次按顺序1、2、3、4、5,第2次按顺序5、4、3、2、1。对双份测定的“离群点”弃去重做。2种方法的相关系数( r)为0.998 3。以 r≥0.975为判别标准, 2种方法明显相关。见 图2。
1.溶血干扰试验 将浓度为10 g/L的血红蛋白液按比例稀释成不同浓度(10、8、6、4、2 g/L),选取新鲜混合脑脊液0.9 mL,分别加入0.1 mL蒸馏水(基础样本)和不同浓度的血红蛋白液(分析样本),用2种方法分别测定脑脊液蛋白,基础样本重复测定20次,求出
| 表2 2种方法检测溶血对试验的干扰比较(g/L) |
2.药物干扰试验 选取临床常用浓度的药物(头孢替安1.2%、奥美拉唑0.4%、替硝唑0.4%、维生素C 0.8%、甘露醇20%)作为干扰物,比较2种方法测定脑脊液蛋白的结果,方法同溶血干扰试验。结果在通常临床应用的药物浓度的干扰下,2种方法检测脑脊液蛋白均不具有明显差异,显示有较好的抗干扰性。
临床测定脑脊液蛋白的方法较多,有苄索氯胺法、双缩脲比浊法、PRM法、SS-S法和免疫学方法等。不同的方法由于所选用的试剂、仪器、条件不同,其敏感性和特异性也不相同。本研究结果显示改良的SS-S法克服了手工操作的诸多因素的影响。R1的加入使无水硫酸钠有充分的时间破坏样本中蛋白质的水化层和双电层,从而提高R2中磺基水杨酸的作用,使蛋白沉淀更为充分和均匀。测定过程中搅拌棒的搅拌,使反应液中的蛋白沉淀颗粒呈稳定的悬浮状态,加上自动化分析仪的高分辨力检测系统和优越的性能,提高了其精密度和准确度,增大了线性范围,SS-S法的线性可达2.333 g/L,高出手工操作试剂说明书上的2.0 g/L。当临床检测某些高出线性范围值样本时,需对其稀释后再测,通过临床可报告范围评价可知改良SS-S法的最高稀释度为1∶10。双试剂终点法的应用能有效去除样本自身的颜色和浊度的干扰。本研究结果显示当血红蛋白<4 g/L,SS-S法抗溶血能力明显强于PRM法,同时对临床常用浓度药物的使用具有很好的抗干扰性。SS-S法和PRM法2种方法相关性良好。
病理性脑脊液含多种蛋白成分,不同中枢系统疾病脑脊液中白球比例不同,磺基水杨酸为生物碱试剂,能沉淀蛋白质,但对白蛋白的沉淀能力比球蛋白强。加入适当的硫酸钠后,同样浓度的白蛋白和球蛋白呈浊趋于一致。PRM法对人白蛋白比人白/球蛋白混合物稍微敏感[ 3]。标准物的选择比使用方法本身重要得多[ 4]。本研究中以定值人新鲜血清作为校准品。对精密度的评价只涉及同一批次配置的试剂,对于不同批次试剂间的精密度有待作出分析、比较。SS-S试剂放置日久易产生微细沉淀,对于样本量少、使用率低的单位要定期关注试剂状态,发现后弃去重新配置。避免使用溶血样本,红细胞中血红蛋白的释放可使测定结果显著升高。
综上所述,改良SS-S法样本用量少,试剂成本低廉,克服了手工操作的诸多不利因素,应用自动化设施,快速、准确、精细,适合临床实验室推广使用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|