作者简介:陈佳,女,1986年生,硕士,主要从事分子生物与临床免疫研究。
通讯作者:韩焕兴,联系电话:021-81886078。
应用生物工程技术克隆、表达聚苯乙烯肽(PS)亲和标签(PStag)和葡萄球菌蛋白A(SPA)免疫球蛋白(IgG)-Fc结合区(ZZ)融合蛋白, 在大肠埃希菌BL21中进行高效表达并初步纯化,为优化、提升免疫检测方法奠定基础。
方法应用基因合成技术串联SPA-ZZ结构域和PStag基因,构建重组表达质粒pPS-SPA,经酶切和测序确认,将阳性重组质粒转化BL21感受态细菌,异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫转印试验(Western blot)鉴定表达和纯化产物;直接酶联免疫吸附试验(ELISA)验证融合表达产物对亲水ELISA板的表面吸附特性和定向结合兔、鼠IgG-Fc区的效果。
结果在合成基因的基础上构建的表达载体经序列分析与限制性酶切证实了串联基因的正确克隆,PAGE结果表明可诱导高表达PStag-SPA,纯化产物对亲水ELISA板的吸附能力较高,表达产物对兔与鼠IgG具有定向吸附能力。
结论重组表达的PStag-SPA具有对ELISA板的黏着能力和定向结合兔、鼠IgG-Fc的应用潜力,为优化酶免疫检测技术提供了技术支持。
To clone the polystyrene (PS) peptide tag (PStag) and staphylococal protein A (SPA) immunoglobin G (IgG)-Fc binding domain (ZZ) and express and purify the protein in
The PStag gene tandem-ligated by the function domain SPA-ZZ was used to construct the recombinant expression plasmid pPS-SPA. The construction was confirmed by the DNA sequencing and enzymatic digestion. Then it was transferred into
The ligated recombined vector was verified to be cloned correctly, and PStag-SPA was highly expressed according to the PAGE result. Direct ELISA result showed that the purified product had high affinity to ELISA plate and the expression product had site-specific binding ability to rabbit and mouse IgG.
ConclusionsThe potential application of the recombined PStag-SPA with high affinity to ELISA plate and site-specific binding ability to rabbit and mouse IgG will provide advantageous technique support to the optimization of immunoassay.
酶免疫分析(enzyme immune assay, EIA)技术无论在医学临床检测领域还是在科学研究领域都是最常用、最基本的方法,其基本原理通常是用某一抗体或抗原包被聚苯乙烯肽(polystyrene,PS)酶标板,利用包被物捕获相应配体,再用另一抗体或标记抗体显示捕获的抗原量,以达到测定目的。蛋白(抗体)吸附是最简便、最常用的包被方法,但这一过程会不同程度的对包被物的生物特性产生影响[ 1, 2],因而对于一种有特定功能域的蛋白质而言吸附包被不是理想状态。有研究表明,亲和多肽标签对PS板有极强的亲和性[ 3~ 5],这一发现对蛋白质定向固定有重要应用价值。另外,有研究尝试将PS亲和标签(PStag)与单链抗体直接融合表达用于酶免疫检测,亦获理想效果[ 6]。定点、定向(site specific)包被被认为是减少包被蛋白活性丢失的最理想的方法[ 7],为优化酶联免疫吸附试验(ELISA)检测过程中的抗体包被效果,进一步提高检测敏感性,本研究将PS的多肽亲和标签与葡萄球菌蛋白A(staphylococal protein A,SPA)免疫球蛋白(IgG)-Fc结合区(ZZ)融合表达并用于IgG-Fc的定向包被,对优化免疫检验、进一步提高检测敏感性进行探索。
1.样本来源 乙型肝炎表面抗原(HBsAg)阳性血清和HBsAg阴性血清均选自长征医院体检人群。
2.材料 载体pET21a为Invitrogen产品,工具酶为New England公司产品,96孔亲水酶标板购自Corning公司,常规ELISA板、小鼠抗HBsAg单克隆抗体由上海荣盛生物药业有限公司惠赠,辣根过氧化物酶(HRP)标记兔抗鼠IgG购自上海卓康生物科技有限公司。
1.PStag的选择与编码基因合成 综合已有文献报道,PStag选用PS19(KRAFIASRRIRRP)序列,Fc结合区选用SPA的B功能域突变体ZZ序列,由上海捷瑞生物工程有限公司完成合成并做相应鉴定。
2.载体的克隆与蛋白表达 将合成序列用限制性内切酶 NdeⅠ和 XhoⅠ双酶切,纯化回收后与相同酶切的质粒pET21a经T4连接酶连接,制备感受态细胞,取连接好的重组质粒转化宿主菌,涂布于LB固体培养基(含有氨苄西林),37 ℃培养16 h,挑取单菌落提取质粒,酶切鉴定。将阳性重组质粒转化到感受态表达大肠埃希菌BL21中,于LB(含有氨苄西林)中37 ℃培养过夜,次日以1∶100的比例接种于新鲜的LB培养液(含有氨苄西林)中,于37 ℃下振荡培养至吸光度( A)600 nm为0.6~0.8时,加入异丙基-β-D-硫代半乳糖苷(IPTG)低温诱导表达4~5 h。
3.表达产物的纯化与鉴定 离心收集菌体后置于冰浴中超声裂解,将上清通过离子交换柱层析纯化SPA目的蛋白。取纯化后的融合蛋白进行免疫转印试验(Western blot)分析:将纯化蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,以100 mA恒流4 ℃转膜3 h,将重组蛋白转移至硝酸纤维素膜上。转移后的膜在室温下封闭1 h,用含有0.75%吐温-20的磷酸盐缓冲液(PBST)洗膜6次后,将膜转至含有HRP标记兔IgG的稀释液中,37 ℃孵育1 h,,洗膜后进行显色反应。
4.PStag-SPA的IgG-Fc结合能力 通过检测表达产物与兔IgG结合鉴定SPA与IgG-Fc段结合能力。具体步骤如下:分别以2、4和8 μg/mL的SPA包被酶标板,封闭洗板后,在每个浓度水平上依次加入0.2、0.4、0.6、0.8和1 μg/mL的HRP标记兔IgG孵育1 h,PBST洗板5次后,加入底物及终止液进行显色测定。
5.PStag-SPA的定向包被ELISA 以表达产物包被酶标板,再与鼠源抗HBsAg单克隆抗体反应,通过双抗体夹心ELISA测定HBsAg阳性与阴性血清,鉴定表达产物的生物特性。简要步骤如下: 以0.4 μg/mL的PStag-SPA,每孔100 μL 4 ℃包被过夜,用3%牛血清白蛋白(BSA) 37 ℃封闭2 h;PBST洗涤5次,加鼠单抗孵育1 h;PBST洗涤后加入待测血清孵育;PBST洗涤后加入酶标羊抗HBsAg, 依次洗涤后加入显色底物200 μL/孔,避光反应15 min,加入2 mol/L硫酸50 μL/孔,读取 A450值。
MKRAFIASRRIRRPGAGAGAEAGITGTWY NQLGSTFIVTAGADGALTGTYESAVGNAESRYVLT GRYDSAPATDGSGTALGWTVAWKNNYRNAHSAT TWSGQYVGGAEARINTQWLLTSGTTEANAWKSTL VGHDTFTKVKPSAASGGGGSGGGGSAEAGITGTW YNQLGSTFIVTAGADGALTGTYESAVGNAESRYVL TGRYDSAPATDGSGTALGWTVAWKNNYRNAHSA TTWSGQYVGGAEARINTQWLLTSGTTEANAWKST LVGHDTFTKVKPSAAS
将上述序列合成连接到pET21a上,N端用 Nde Ⅰ酶切位点,C端用 Xho Ⅰ酶切位点,而且C端带上His tag(终止子放在His之后);酶切与测序鉴定正确无误(测序与电泳图略),以该载体转化大肠埃希菌。
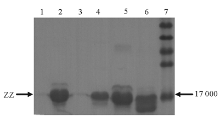
基于PAGE的Western blot分析结果显示,经IPTG诱导的2个菌株表达出的融合蛋白在相对分子质量17 000处出现条带,其大小与预期的融合蛋白相对分子质量相一致,并且Western blot结果也证实PStag-SPA已在大肠埃希菌中得到成功表达,见 图1。
PStag-SPA与HRP标记兔IgG结合曲线见 图2,在相同SPA浓度下,随着加入到酶标板中的兔IgG浓度升高,与固相载体上SPA结合的IgG量也相应增加,表明SPA与兔IgG的结合能力较好,并且随着包被浓度的升高,IgG结合量也略有升高。
将SPA包被酶标板定向结合鼠IgG,对HBsAg阳性与阴性血清进行ELISA测定,结果见 表1。PStag-SPA预包被后具有结合鼠IgG的能力,且随着一抗稀释倍数的增加或稀释阳性血清,相应的 A值也呈下降趋势。表明制备的表达产物可用于ELISA测定中IgG的定向结合,如在传统ELISA的基础上,对酶标板进行PStag-SPA的预包被处理,则会明显缩短抗体包被时间,大大提高检测效率。
| 表1 SPA定向包被ELISA测定结果 |
SPA具备对某些生物IgG-Fc特别的高亲和结合能力,因而广泛应用于免疫检测、抗体纯化、多肽筛选和医学芯片等领域,国内亦有众多克隆与表达的相关报道[ 8, 9]。PS多肽亲和标签的研究则限于国外,亦有将亲和标签与链球菌蛋白G的某个功能域、谷胱甘肽S-转移酶(GST)等融合表达的研究[ 10],但未见将PStag与SPA直接融合表达用于EIA的报道。本研究以人工修饰的ZZ结构域基因代替野生型SPA的E、D、A、B、C结构域,并与PStag的编码基因进行串联构建重组表达质粒,在大肠埃希菌中成功表达了融合蛋白PStag-SPA,并试用于免疫检测获初步结果。
将PStag-SPA融合蛋白预包被酶标板应用于免疫检测,避免了IgG抗体直接吸附固相载体所形成的、可能的对抗原结合的影响,降低了在固定过程中所造成的抗体活性损失。此外, 基于SPA能够结合大多数类型IgG-Fc段的特性,可通过将PStag-SPA与固相载体结合,制备针对不同检测物质的免疫分析商品化通用载体,对于提高免疫检测分析效率、降低检测成本具有重要意义。本研究结果表明,PStag具备吸附酶标板的作用,而预包被PStag-SPA后能够形成小鼠单克隆抗体的定向结合,为进一步的功能验证和使用奠定了基础。PStag对PS板的吸附强度,抗洗脱能力(含去垢剂的洗液),其中的SPA-ZZ抗体结合能力,与野生型的比较,PStag位置、连接片段等因素对其生物特性的影响等逐项内容有待进一步的研究和优化,尚需对该融合蛋白的生物学性质、空间结合机制和影响因素进行全面鉴定,使之作为免疫检测商业化产品得到实际、广泛的应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|