作者简介:向莉,女,1980年生, 硕士,助教,主要从事肿瘤机制和抗体工程研究。
通讯作者:段勇,联系电话:0871-5324888-2748。
制备铜绿假单胞菌(PA)主动外排系统外膜蛋白OprM及抗OprM多克隆抗体,为深入研究主动外排系统奠定基础。
方法从PA基因组中克隆oprM基因,构建pET28a-c-OprM表达载体,在大肠埃希菌中经异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达并用免疫转印试验(Western blot)验证,建立重组OprM纯化方案,免疫动物制备多克隆抗体。
结果扩增出带有
成功制备了OprM蛋白和抗OprM多克隆抗体,为深入研究该蛋白及相关的主动外排系统提供了有效手段。
To obtain an active efflux system outer membrane protein OprM of Pseudomonas aeruginosa(PA) and the OprM polyclonal antibodies, and promote the studies on active efflux system of PA.
MethodsThe oprM gene was amplified from PA genome. The expression of pET28a-c-OprM was constructed,expressed and induced in Escherichia coli by isopropyl-beta-D-thiogalactopyranoside (IPTG), and the results were verified by Western bolt. The purification of recombinant OprM was established. It was used as the immunogen to produce polyclonal antibodies in mice.
ResultsThe oprM gene with EcoR Ⅰ and Not Ⅰ enzyme sites and basyl protection was amplified, and the expression vector of pET28a-c-OprM was constructed. The recombinant expression-induced OprM was insoluble inclusion body with His tag. The protocols to purify recombinant OprM were established and optimized, and OprM polyclonal antibodies were produced in immunized mice.
ConclusionsThe recombinant OprM protein is successfully purified, and OprM polyclonal antibodies are obtained. They will be useful to deeply explore the biological functions of OprM and relative active efflux system.
铜绿假单胞菌( Pseudomonas aeruginosa,PA)的感染在多项病原菌流行病学监测中均高居院内感染病原菌榜首[ 1, 2]。近年来PA耐药菌株逐年上升,耐药状况十分严重,究其耐药机制,主动外排系统是其存在耐药性并发生获得性多重耐药的主要原因[ 3]。外膜蛋白OprM参与组成PA多种主动外排系统,在PA耐药的主动外排机制中具有重要作用[ 4]。目前,对于OprM的研究表明在耐药的PA菌株中OprM均呈高表达[ 5~ 8]。基因是相对静态的,而蛋白质是功能的主要体现者与执行者,蛋白表达除受基因表达水平影响外还受翻译后修饰等影响。因此,对OprM蛋白表达水平的研究有利于进一步研究PA的耐药机制。本研究采用蛋白原核表达系统对OprM进行体外表达,并免疫动物进行抗体制备,为进一步研究奠定基础。
质控标准菌株铜绿假单胞菌(ATCC 27853)购自卫生部临床检验中心;DH5α和BL21(DE3)感受态细胞购自Tiangen公司。pMD18-T Vector等分子生物学试剂为大连宝生物公司产品;pET28a-c(+)、小鼠抗His·Tag 单克隆抗体购自Novagen公司。核酸提取和纯化试剂盒购自上海捷瑞生物工程公司。聚合酶链反应(PCR)增强剂、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG抗体购自Invitrogen公司。
1.引物设计 上游引物序列为5'-CGGAATTCATGAAACGGTCCTTCC-3',下游引物序列为5'-ATAAGAATGCGGCCGCTCAAGCCTG-GGGATC-3',目的片段大小为1 483 bp。
2.PCR扩增反应体系 dNTP 200 μmol/L,MgSO4 1.5 mmol/L,引物为400 nmol/L,Pfu.1 U/μL,模板约100 ng,1×反应缓冲液,总体系50 μL。反应条件为:95 ℃预变性5 min,95 ℃ 45 s、50 ℃ 1 min、72 ℃ 2 min,循环次数35,72 ℃延伸7 min。以PCR扩增产物为模板,加Taq DNA聚合酶0.6 μL(3 U),于72 ℃延伸20 min,在PCR产物3'端引入碱基A。
3.PCR扩增产物鉴定 对产物经琼脂糖凝胶电泳鉴定。
将纯化后的目的片段与pMD18-T进行连接,转化感受态大肠埃希菌DH5α。重组菌进行蓝白斑筛选、菌落PCR和用 EcoRⅠ和 NotⅠ进行单酶和双酶切验证。将菌落PCR和酶切正确的重组质粒进行测序,将测序正确的重组质粒进行增菌和保存。
pMD18-T-OprM和pET28a-c载体用 EcoRⅠ和 Not Ⅰ进行双酶切,目的片段和载体纯化、连接、转化。对重组质粒进行菌落PCR和双酶切验证,并将阳性的质粒送测序,测序正确的重组质粒用于后续蛋白试验。
1. 重组表达质粒转化BL21菌 用含卡那霉素(终浓度为0.05 mg/mL)的LB培养基进行增菌,37 ℃振荡培养,当生长到浓度为OD600约为0.6时,加入终浓度为1.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),25 ℃振荡培养过夜。4 ℃条件下10 000 r/min(离心半径为7.5 cm)离心5 min收集菌体,将菌体用磷酸盐缓冲液(PBS,pH值为7.2~7.4)洗涤,加入蛋白酶抑制剂,于冰上超声破细胞,12 000 r/min(离心半径为7.5 cm)离心20 min,取上清和沉淀进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
2. 免疫转印试验(Western blot)验证 第一抗体为小鼠抗His·Tag 单克隆抗体。
重组菌大量诱导表达,取沉淀加入6 M尿素,磁力漩涡搅拌2 h后离心取上清即为包涵体裂解物,之后进行SDS-PAGE和染色。将目的蛋白条带切下,收集于透析袋中,袋中加入转移缓冲液,两端夹闭,将透析袋放入盛有转移缓冲液的水平电泳槽,4 ℃电泳,待SDS-PAGE胶中考马斯亮蓝染液全部转移到胶外时停止。取出透析袋放置于盛有聚乙二醇(PEG) 20000的平皿中,去除多余水分,收集透析袋中蛋白溶液,取少量电泳证实纯度后-80 ℃保存。
以弗氏完全和弗氏不完全佐剂作为佐剂,超声乳化抗原,于小鼠背部皮内多点注射进行免疫。每只小鼠每次注射0.4 mg OprM,[酶联免疫吸附试验(ELISA)用切胶蛋白作为包被抗原]测定抗体效价,加强免疫4次后(64 d)采血并处死动物, 收集抗血清, 用50%、33%饱和硫酸铵初步纯化抗体,透析除盐,测抗体浓度, 用50%甘油、0.02%叠氮钠保存抗体于-20 ℃。
分别制备对照、表达和标准菌液并提取蛋白,测定浓度后取相同浓度上清电泳,浓缩胶浓度5%,分离胶10%;15 V 15 min半干转印于聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉封闭过夜;1∶1 000的小鼠抗OprM多克隆抗体,室温孵育1 h;洗膜3次;1∶5 000的HRP标记羊抗鼠IgG二抗,室温孵育1 h;洗膜3次;化学发光,显影,定影。抗体的纯度和效价显示抗体较纯。
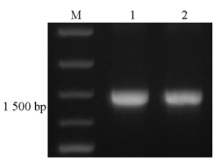
使用oprM基因特异性引物进行PCR扩增,可见与预期产物1 483 bp大小相符的特异性产物,PCR产物纯化后条带单一,结果见 图1。
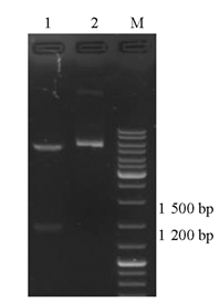
pET28a-c-OprM质粒用oprM基因特异性引物进行菌落PCR鉴定,PCR产物大小与插入片段大小相符。重组质粒经 EcoRⅠ和 NotⅠ双酶切,酶切出的小片段与插入片段大小相符,见 图2。经大连宝生物公司测序,测序结果显示目标序列按预期目的亚克隆入pET28a质粒相应位点,插入序列经Blast比对,目的基因DNA序列有一个碱基发生同义突变。
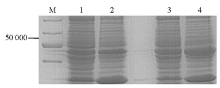
IPTG诱导pET28a-c-OprM表达目的蛋白OprM,细菌破细胞膜后,将上清和沉淀的蛋白进行SDS-PAGE,结果沉淀中50 000附近的蛋白量远高于上清,见 图3,显示诱导表达的目的蛋白OprM主要为包涵体。
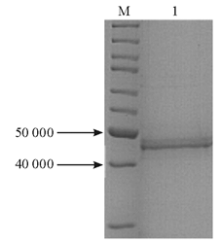
将上清和沉淀的蛋白进行Western blot,结果沉淀中50 000附近的蛋白量远高于上清,表达菌在50 000附近的蛋白表达量远高于对照菌,见 图4。结果表明,带有His标签的蛋白相对分子质量与目的蛋白OprM相符,且蛋白以包涵体形式存在。
用ELISA检测第4次免疫后抗体效价达1∶1 000,用饱和硫酸铵对抗体进行初步纯化。以纯化后的小鼠抗OprM多克隆抗体作为一抗,对原核表达菌(含pET28a-c-OprM)、PA标准菌株和空白对照菌株进行Western blot,表达菌和PA标准菌株在约50 000处出现条带,对照菌则无,见 图6。结果显示,抗OprM多克隆抗体能够特异地识别目的蛋白发生。
PA的多种耐药机制导致其对抗菌药物产生耐药,其中的主动外排系统是其存在耐药性并发生获得性多重耐药的主要原因[ 3]。目前,PA中已发现7种多药主动外排系统,均由内膜质膜转运体、膜融合蛋白和外膜蛋白3部分组成。外膜蛋白OprM参与其中4种主动外排系统的组成,是外源性异质的外排孔道蛋白,大小为485个氨基酸[ 8~ 10]。目前,细菌的主动外排系统在细菌耐药机制研究中越来越得到人们的重视,减少主动外排系统的表达可能是今后必须解决的问题和研究方向。目前,还没有商品化的抗OprM抗体,这也限制了在蛋白水平的研究。
本研究用原核、载体表达OprM蛋白,通过将克隆化基因插入合适载体后在大肠埃希菌表达系统中进行表达。本研究中表达的蛋白主要是以包涵体形式存在,但不影响后续抗体的制备。本研究结果表明所制备的多克隆抗体能够正确识别PA标准菌株和表达菌株中所表达的目的蛋白。
本研究所得到的多克隆抗体经Western blot验证时发现特异性还不是很理想,究其原因可能是:(1)本研究所制备的抗体为多克隆性抗体,因此抗体的特异性很难达到理想状态;(2)OprM蛋白表达后可能存在不同的修饰方式,从而造成不同相对分子质量的OprM蛋白出现,最终在Western blot时出现多个条带;(3)可能在Western blot时OprM蛋白出现部分降解;(4)抗体经制备后只经过初步纯化,可能进一步对抗体进行纯化后能改善Western blot的结果。
在进一步研究中将采用单克隆抗体制备方法和更先进的抗体纯化方式来解决抗体的特异性问题,进一步深入PA耐药机制的研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|