作者简介:邬建民,男,1959年生,主管技师,主要从事临床检验工作。
根据美国临床实验室标准化委员会(NCCLS)的评价方案评价胆红素氧化酶(BOD)法直接胆红素(DBil)测定试剂盒,并观察其临床应用的可能性。
方法采用BOD法测定血清DBil,并对其精密度、线性范围、干扰因素及相关性进行分析。
结果低值与高值的批内精密度( CV)分别为0.9%、0.5%;批间精密度( CV)分别为1.27%、 0.92%;线性范围至少可达844 μmol/L。BOD法( Y)与日本关东化学株式会社试剂盒( X)的测定结果比较,差异无统计学意义( P>0.05),相关方程为 Y= 0.976 X-0.528, r = 0.991。血红蛋白(Hb)≤5.0 g/L、维生素C≤500 mg/L、乳糜≤5 000单位对BOD法无干扰。不同厂家的试剂盒对DBil的测定灵敏度、特异性有所不同。
结论采用BOD法测定DBil具有良好的分析特性,可在临床推广使用。
血清直接胆红素(DBil)测定的传统方法是重氮法。该法受测定因素影响大, 结果一致性差, 不能准确、灵敏地反映血清DBil水平。这是因为传统的DBil测定结果包含了δ -胆红素及部分非结合(游离)胆红素。另外, 试剂盒采用的促进剂种类不一, 也影响了结果的一致性。近来胆红素氧化酶(bilirubin oxidase, BOD)测定试剂盒已逐渐进入临床, 可望得到一个特异性好、灵敏度高的测定方法。
1. 仪器
日立7060全自动生化分析仪。主要参数:温度 37 ℃, 波长(主/副) 450/660 nm, 样本量10 μ L, 试剂1(R1)270 μ L, 试剂2(R2)90 μ L, 测量点 15、31。
2. 评价试剂
申索佑辐医学诊断用品有限公司(简称申索公司)提供的DBil测定试剂盒(BOD法)。批号20100610。主要成份:R1为缓冲液, R2为BOD。
3. 对照试剂
日本关东化学株式会社(简称关东化学)的BOD法测定试剂盒, 批号H0D12; 申索公司重氮法试剂盒, 批号20100520。分别按其试剂盒说明书要求进行操作。
4. 校准品
由申索公司提供的赋值的胆红素校准液, 产品编号:77696; 日本关东化学的胆红素校准液, 产品批号:H9R04。
5.干扰剂选择
维生素C(Vit C)注射液(上海禾丰制药厂, 批号101009); 脂肪乳剂250 mL(江苏花蕊制药厂, 批号80BH033)。血红蛋白(Hb)标准品(上海生物工程技术服务有限公司, 批号38E10515)
1. 原理
样本中的DBil在pH值 7.2的条件下被试剂中的BOD氧化为胆绿素, 在450 nm处吸光度下降, 其下降的程度与样本中DBil含量成正比, 藉以定量。
2. 精密度实验
按美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standards, NCCLS) EP5-T2文件[2]进行操作。取高、低值混合血清分装, 并于-70 ℃避光冰冻保存。
3. 线性评价
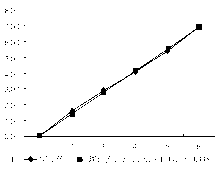
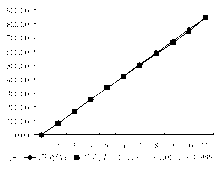
参考NCCLS EP6-P文件[3]对BOD法进行评价, 取DBil浓度为844.7 μ mol/L的血清(申索公司提供), 分成高、低浓度组, 低浓度组稀释成5个不同浓度的样本(1.39、2.77、4.16、5.54、6.93 μ mol/L), 高浓度组稀释成10个不同浓度的样本(84.5、168.9、253.4、337.9、422.4、506.8、591.3、675.8、760.2、844.7 μ mol/L), 每个样本测定2次, 当天完成。
4. 比较实验
按照NCCLS EP9-A2文件[4]对BOD法进行评价, 取住院及门诊患者40份。分别用BOD法(Y)和关东化学BOD法(X)测定其DBil含量。计算相关系数(r)及回归方程。
5. 干扰实验
参考NCCLS EP7-P文件[5]对BOD法进行评价。取混合血清(DBil为3.8 μ mol/L), 分成3组, 每组6份, 每份500 μ L。各组每份混合血清分别加入等体积(500 μ L)不同浓度的Hb(浓度分别为0、1.0、2.0、3.0、4.0、5.0 g/L)、Vit C(浓度分别为0、100、200、300、400、500 mg/L)、乳糜(浓度分别为0、1 000、2 000、3 000、4 000、5 000单位)。空白管(0浓度干扰物管, 加入500 μ L生理盐水)连续测定20次, 其余各管重复测定3次取均值。以3次检测均值在空白管平均值95%可信区间内为无明显干扰。
6. 特异性实验
取混合血清, 测定其总胆红素为11.97 μ mol/L, DBil浓度为3.23 μ mol/L。并按照0∶ 5、1∶ 5、2∶ 5、3∶ 5、4∶ 5和5∶ 5等不同体积比与含17 μ mol/L非结合胆红素的溶液(添加物, 申索公司提供)混合。分别利用重氮法、关东化学BOD法和本BOD法重复测定各混合物中DBil浓度3次, 取其平均值。分析不同检测结果与理论值间的差异。
数据统计用SPSS13.0统计软件进行数据统计。P< 0.05表示差异有统计学意义。
DBil氧化酶法高、低值批内变异系数(CV)分别为0.5%、0.9%, 均在CLIA'88要求的1/3允许误差(EA)范围内; 高、低值批间CV分别为0.92%、1.27%, 均在CLIA'88要求的1/4 EA范围内, 结果见表1。
| 表1 BOD法精密度测定 |
用2种BOD法分别检测不同浓度(0~300 μ mol/L)的 血清样本。将本BOD法DBil结果(Y)与关东化学BOD法(X)进行比较, 差异无统计学意义(P> 0.05), 相关方程为Y = 0.976X-0.528, r= 0.991。
空白管中DBil浓度平均值是1.89 μ mol/L, s为0.02, 95%可信区间为1.85~1.93 μ mol/L。其他各管检测结果表明, Hb≤ 5.0 g/L、维生素C≤ 500 mg/L、乳糜≤ 5 000单位的干扰物均在空白管均值的95%可信区间内, 对BOD法无干扰。
本研究按NCCLS评价方案的要求对申索公司提供的BOD法DBil测定试剂盒作一初步评价。DBil浓度在844 μ mol/L内线性良好, 批内CV分别为0.9%、0.5%, 批间CV分别为 1.27%、0.92%。对溶血、Vit C、乳糜等的抗干扰能力也完全符合体外诊断试剂的要求。本BOD法和关东化学的BOD法具有良好的相关性(r> 0.975)。
BOD在分子氧的存在下, 氧化胆红素形成胆绿素。可以检测DBil和与葡萄糖醛酸结合的胆红素[5]。当反应液pH值接近8时, 酶可有选择地氧化2个葡萄糖苷酸的胆红素[6, 7]。而δ -胆红素不会被氧化, 仅5%的游离胆红素被当作结合胆红素[7]。
从对试剂盒特异性的可见, 重氮法的结果明显高于BOD法, 这也说明了非结合胆红素对重氮法的干扰。表2中也显示了同样是BOD法, 结果相差还是很大的。对这个问题, 在美国临床病理学会(CAP)每年的调查结果中, DBil结果最差, 特别要注意的是现今所有在分析仪上使用的DBil检测方法, 因仪器设定的限制, 没有一个符合Doumas[8]推荐的DBil检测的条件。所以, DBil结果只能在相同的检测系统内进行比较, 各个检测系统间毫无可比性可言。
综上所述, 用BOD法测定DBil是一个特异性好、灵敏度高的测定方法。适用于全自动分析, 具有操作简单、快速和节省试剂的特点。但试剂盒反应条件的优化方案、对BOD与结合胆红素“ 特异性氧化“ 的反应条件的认定, 使之尽可能地降低BOD对非结合胆红素和δ -胆红素的“ 非特异性” 氧化等, 乃是判断试剂盒质量优劣的重要指标。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|