作者简介:周韵娇,女,1981年生,学士,技师,主要从事细胞免疫研究工作。
探讨二硫苏糖醇(DTT)对流式细胞术测定诱导痰液中淋巴细胞亚群结果的影响。
方法将15名健康人的诱导痰各分为2份,1份按DTT液化诱导痰液程序处理(DTT组),另1份在实行该处理程序后,再用磷酸盐缓冲液(PBS)洗涤2次(DTT+PBS 组),以除去残留DTT。采用流式细胞术分析2组样本中的淋巴细胞亚群百分率及平均荧光强度(MFI)。
结果与DTT+PBS组比较,DTT组CD3+CD4+细胞和自然杀伤(NK)细胞百分率明显增加(
DTT对诱导痰液中淋巴细胞亚群百分率及MFI检测结果产生影响,诱导痰经DTT液化后应增加PBS洗涤步骤,以去除残留的DTT,降低DTT前处理对结果的影响。
To investigate the influence of dithiothreitol (DTT) on lymphocyte subset determination in induced sputum by flow cytometry.
MethodsInduced sputums from 15 healthy subjects were divided into 2 portions. One was processed by DTT according to the standard sputum liquefaction procedures (DTT group), and the other was washed twice by phosphate buffer saline (PBS) following the standard procedure (DTT + PBS group) to remove the DTT remained. Mean fluorescence intensity (MFI) and the cell percentage were analyzed.
ResultsCompared with DTT+PBS group, the CD3+CD4+ lymphocyte and natural killer (NK) cell percentages significantly elevated (
DTT affects the results of analyzing the percentage and MFI of lymphocyte subsets in induced sputum. Washing by PBS should be performed following DTT processing to remove DTT remained, so as to reduce the influence of DTT on the analyzing results.
以高渗盐水雾化吸入获得的诱导痰液(induced sputum)因能更真实地反映气道分泌物自然状态下的浓度,具有更集中的细胞和生化物质成分[ 1],被广泛用于哮喘、慢性阻塞性肺疾病等气道局部炎症机制的研究。在气道疾病中,淋巴细胞扮演着重要的角色,其在诱导痰液中数量的变化,也越来越受到人们的关注[ 2]。但痰液含有大量的气道分泌物,为了不影响其中细胞组成和生化成分的分析,在进一步研究分析前必须采用合适的方法对痰液进行液化,以去除其中蛋白质等成分。
二硫苏糖醇(DTT)具有强还原性,能通过破坏蛋白质中的二硫键达到液化的目的。与此同时蛋白质的三维结构也会受到影响,从而导致抗原决定簇的改变,但这种改变是否会影响最终的检测结果,尚无定论。为了探讨DTT对诱导痰液中淋巴细胞表面抗原检测结果的影响,我们在DTT处理诱导痰液程序的基础上,增加了磷酸盐缓冲液(PBS)洗涤步骤,并比较了两者的试验结果。
15名健康人根据诱导痰液程序[ 6],将诱导痰液样本置于无菌的痰杯内,其中男8名、女7名,年龄2227岁。
1.试剂 双色淋巴细胞亚群分析检测试剂盒购自美国Becton-Dickinson(BD)公司[抗体组成为CD3/CD4、CD3/CD8、CD3/CD19、CD3/CD16+56、IgG1/IgG2a、CD45/CD14,均为异硫氰酸荧光素(FITC)/藻红蛋白(PE)双色标记];DTT购自Solarbio公司;标准荧光微球购自美国Beckman-Coulter公司。
2.仪器 Beckman-Coulter Epics-XL流式细胞仪。
1.标本制备 将15名健康人的诱导痰液称重后各分为2份,1份根据痰液处理的标准程序[ 6]处理(DTT组),另1份在诱导痰液DTT处理后,再用PBS洗涤2次(DTT+PBS组),尽可能除去残留DTT。根据试剂盒说明书,将重悬后的细胞与不同组成的双色荧光抗体在室温下温育20 min,洗涤后待测。
2.流式细胞仪检测 用标准荧光微球对流式细胞仪的光路进行校准(激发波长:488 nm),每份标本计数10 000个细胞,采用侧向角散射(SSC)和前向角散射(FSC)进行细胞分群,记录CD3、CD4、CD8、CD19、自然杀伤(NK)细胞的百分率和平均荧光强度(means fluorescence intensity,MFI),所有标本检测2次,结果取平均值。
数据以 
与DTT+PBS组比较,DTT组CD3+CD4+和NK细胞百分率均明显增高( P<0.05、 P<0.01),CD3+CD8+和CD3-CD19+细胞百分率均明显降低( P<0.01);而CD3+细胞百分率差异无统计学意义( P>0.05)。见 表1。
表1 DTT组与DTT+PBS组淋巴细胞亚群百分率比较(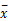 ±s,%) ±s,%) |
与DTT+PBS组比较,DTT组CD3+CD8+和CD3-CD19+细胞的MFI均明显减弱( P<0.01、 P<0.05),NK细胞的MFI明显增强( P<0.05);而CD3+和CD3+CD4+细胞MFI差异无统计学意义( P>0.05)。见 表2。
表2 DTT组与DTT+PBS组淋巴细胞亚群MFI比较(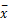 ±s) ±s) |
诱导痰法作为一种非侵入性、简便易行的直接测定气道炎症的方法[ 7, 8],可以更好地反映气道分泌物自然状态下的浓度,具有更集中的细胞和生化物质成分,被广泛用于呼吸道疾病的研究。尤其是诱导痰液中淋巴细胞数量的改变,已被用于哮喘等呼吸道疾病治疗监测的参考指标和发病机制的研究。Domínguez Ortega等[ 9]的研究表明,诱导痰液的流式细胞分析是一种用于研究支气管免疫细胞可靠的非侵入性方法,并可以提供非吸烟者及哮喘患者支气管黏膜中细胞活化的信息和疗效控制。
痰液中含有大量以黏蛋白和糖蛋白为主的气道分泌物,如黏液、各种炎症细胞及坏死脱落的黏膜上皮细胞等[ 10],组成成分复杂,给进一步的研究分析带来困难。为了将痰液中的细胞从这些混合物中分离出来,一般采用强还原剂DTT,通过破坏蛋白结构中的二硫键,达到液化的目的。然而在破坏黏蛋白分子结构的同时,可能会影响膜蛋白的三维结构,从而影响细胞表面抗原与相应抗体的特异性结合,最终影响基于抗原-抗体反应的流式细胞术测定免疫细胞表面分子的结果。
采用流式细胞术分析痰液中免疫细胞的技术较为成熟,但是有关还原剂DTT的处理是否对流式细胞术检测结果(百分率、荧光强度)产生影响还存在争议。Loppow等[ 11]用流式细胞术测定分别用PBS和DTT处理的外周血细胞表面分子的百分率和MFI,结果显示DTT处理组CD16+细胞的MFI显著增加,CD2+、CD45+、CD14+细胞的MFI明显下降,而CD3+、CD4+、CD8+、CD19+、CD56+、HLA-DR+细胞的MFI变化无统计学意义;CD16+、CD56+、HLA-DR+细胞的百分率显著增加,CD2+、CD3+、CD4+、CD8+、CD45+细胞百分率下降,而CD19+细胞百分率的变化无统计学意义,故认为DTT对细胞表面抗原的检测结果影响程度较小,因而不会干扰诱导痰液中淋巴细胞亚群的最终结果。Qiu等[ 11]比较了经PBS和不同浓度DTT(0.1%、0.25%、0.5%和1%)处理的外周血中淋巴细胞(Lym)、嗜酸性粒细胞(Eso)和中性粒细胞(PMN)表面分子的MFI,提示与PBS组相比,不同浓度DTT组的PMN表面CD16的MFI变化均无统计学意义,该结果有别于Loppow等[ 11]的研究结果,可能是由于两者统计学方法上的差异所致;Lym、Eso和PMN表面CD11a的MFI随DTT浓度增加呈剂量依赖性下降,而Lym、Eso和PMN表面CD11b的MFI却显著升高,但无剂量依赖性;Lym和Eso的CD49d的MFI随DTT浓度增加而递降,PMN的CD49d的MFI变化无统计学意义;Lym的CD2的MFI呈剂量依赖性下降,而HLA-DR的MFI改变无统计学意义,与Loppow等[ 12]的结论相符;Eso的EG2的MFI在DTT浓度为0.1%时,较PBS组显著增加,其他浓度的DTT组EG2的MFI较PBS组显著下降,因而认为DTT影响Lym、Eso和PMN表面抗原的表达,并建议对诱导痰液中相应指标是否有同样的变化作进一步的研究。Van Damme等[ 13]采用流式细胞术比较了不同化学试剂[DTT、乙二胺四乙酸(EDTA)]和酶(胶原酶和DNA酶)对扁桃体及外周血T淋巴细胞表面抗原的影响,结果表明,经DTT和EDTA处理的淋巴细胞CD38、αEβ7、α4β7表达下降,其中EDTA主要使αEβ7、α4β7百分率显著下降,DTT和DTT+EDTA不仅使αEβ7、α4β7的百分率下降,而且使L-选择素和CD38百分率显著下降;与此相比,CD25和CD44的下降程度较小,CD44、L-选择素和CD38百分率的下降与MFI减弱平行;经胶原酶A和DNA酶处理的淋巴细胞CD25、L-选择素、αEβ7、α4β7百分率均显著下降;此外,胶原酶A还使CD38和CD4百分率显著下降,而对CD8无显著影响;相反,DNA酶使CD8百分率显著下降而对CD4无显著影响。故认为在解释酶分离技术获得的淋巴细胞表型分析结果时应谨慎,由于不同试剂对血细胞表面分子作用的原理及破坏的程度不同,因此最终的试验结果存在差异。Domínguez Ortega等[ 14]比较了流式细胞术分析0.1 mol/L(1.54%)DTT处理与未处理的诱导痰液中血细胞表面黏附分子的结果,发现经DTT处理的诱导痰液中Eso胞内和胞外的很晚期活化抗原4(VLA-4)远低于预期,Lym表面VLA-4的变化较Eso小;DTT处理后的全血样本中VLA-4水平也下降,而Eso表面的CD29和Lym上的β-7链未见显著变化。故认为流式细胞术可作为气道炎症时的诱导痰液检测的补充方法,但DTT可能会干扰一些炎症分子(如VLA-4)的检测结果。这些研究分别探讨了DTT对不同细胞表面的不同抗原分子检测结果的影响,但多数仅局限于外周血细胞,本研究直接采用诱导痰液标本,探讨DTT对诱导痰液中淋巴细胞表面抗原CD3、CD4、CD8、CD19和NK细胞的影响。
为了获得更准确可靠的试验结果,检测前本研究采用标准荧光微球对仪器进行光路校准,使得Half变异系数( CV)<2%。为了消除背景荧光对试验的干扰,本研究采用同型对照调节电压。
本研究结果表明,与DTT+PBS组相比,除了CD3+细胞差异无统计学意义( P>0.05)外,DTT组阳性细胞百分率变化差异均有统计学意义,表现为CD3+CD4+、NK细胞分别增加了2.06%、1.73%,而CD3+CD8+、CD3-CD19+细胞分别减少了3.02%、3.59%。至于MFI,与DTT+PBS组比较,CD3+、CD3+CD4+细胞差异无统计学意义( P>0.05),DTT组CD3+CD8+、CD3-CD19+细胞的MFI减弱,而NK细胞的MFI增强,这可能是抗体与细胞表面非特异性结合的量增多有关,此结果与Loppow等[ 12]的报道部分相同。
上述结果表明,细胞荧光强度的减弱与相应细胞百分率的减少平行。这可能有两方面的原因,一方面可能是细胞表面蛋白结构的破坏导致特异性结合的荧光抗体数量减少,引起阳性细胞百分率减少;同时,相邻抗原决定簇的暴露,会导致荧光抗体的非特异性结合[ 11],引起阳性细胞百分率增多;这2种作用的抗衡,决定了最终的结果;另一方面在于抗体与细胞表面抗原结合的同时,残留DTT会进一步破坏细胞的形态,从而影响抗体与细胞表面抗原的特异性结合。
本研究与其他学者[ 1214]采用外周血细胞作为诱导痰液细胞模型相比,更直观和可靠地反映了诱导痰液细胞的真实情况。由于外周血细胞和诱导痰液细胞所处基质不同,使得DTT直接作用于细胞表面的浓度也不同,从而对细胞表面抗原的破坏程度也存在差异,导致了最终试验结果的差异。Van Damme等[ 13]采用不同的化学试剂和酶处理淋巴细胞,由于不同试剂和酶的作用机制不同,对细胞表面抗原的影响肯定会有差异。本研究仅对诱导痰液中较常用的淋巴细胞表面分子CD3、CD4、CD8、CD19和NK细胞进行了探讨,DTT是否会对诱导痰液中淋巴细胞表面的其他分子或其他细胞的表面分子产生影响,还有待进一步研究。
总之,DTT对诱导痰液中淋巴细胞亚群百分率及荧光强度有一定的影响,但这种影响的确切机制尚未完全阐明。为了使影响程度尽可能减小,在对经DTT处理的痰液中的细胞进行免疫测定前,必须增加PBS的洗涤步骤,减少细胞悬液中DTT的残留量,防止残留DTT对细胞膜抗原的进一步破坏,从而降低DTT对试验结果的影响。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|

