通讯作者:郝晓柯,联系电话:029-84775455
作者简介:周 珊,女,硕士,检验师,主要从事临床微生物学检验与研究。
制备天然和重组肝素结合血凝素(HBHA)蛋白,探讨其在结核杆菌感染诊断中的应用价值。
方法用聚合酶链反应从结核分枝杆菌H37Rv基因组扩增出
所得天然和重组HBHA蛋白均有诱导BCG聚集的作用,并均可被多克隆抗体抑制。
结论成功获得天然HBHA和重组HBHA蛋白;证实了两者均具有促进BCG聚集的功能,并可被由重组HBHA诱导产生的多克隆抗体所抑制。从而为进一步研究HBHA的临床诊断价值提供了实验依据。
To purify native and recombinant heparin-binding haemagglutinin (HBHA) proteins, and investigate the application value in clinical diagnosis of tuberculosis.
MethodsThe
The native and recombinant HBHA proteins could induce the BCG aggregation, which could be inhibited by both polyclonal antibodies.
ConclusionsThe native and recombinant HBHA proteins are successfully obtained. It is proved that the recombinant HBHA protein could induce the aggregation of BCG as similar as native HBHA protein, and polyclonal antibody against recombinant HBHA protein could be also inhibit the activity of native HBHA protein. It suggests that HBHA could be further used in clinical diagnosis and research of HBHA.
结核分枝杆菌致全世界近1/3的人受到感染,每年新发结核患者达800万,200万人死于结核病[ 1]。到目前为止,被研究证实的结核分枝杆菌致病因子并不多。其中,肝素结合血凝素(heparin-binding hemagglutinin adhesin,HBHA)蛋白是近年来研究发现的结核分枝杆菌重要致病因子之一[ 2]。HBHA蛋白是一个相对分子质量为28 000的细菌表面黏附素,具有诱导结核分枝杆菌粘附非巨噬细胞,介导结核分枝杆菌肺外播散等多种生物学活性。目前已知,HBHA蛋白具有较强的抗原性,可诱导机体产生相应的抗体。为进一步探讨其诱导的保护作用以及其临床诊断价值,我们表达纯化了HBHA重组蛋白,制备多克隆抗体,测定了其对重组HBHA和天然HBHA蛋白活性的抑制作用。
结核分枝杆菌H37Rv标准株(ATCC27294)、大肠埃希菌DH5α、BL-21株均由本室保存。载体PQE-80L以及鼠源性HBHA多克隆抗体由第四军医大学实验动物中心馈赠。质粒微量提取试剂盒,DNA凝胶回收试剂盒为Promega公司产品;Taq DNA 聚合酶、dNTPs、T4连接酶、限制性内切酶HindⅢ及BamHⅠ、异丙基硫代-β-D-半乳糖苷(IPTG)为TaKaRa公司产品;Heparin Sepharose CL-6B、His Gravitrap购自美国GE Healthcare。
取结核分枝杆菌H37Rv株培养菌落,用接种环小心取菌,置于200 μL生理盐水(1.5 mL离心管)中,菌株浓度为10 g/L。100 ℃煮沸灭活15 min,12 000 r/min(离心半径5 cm)离心20 min,留取干燥沉淀,加蛋白酶K裂解液150 μL,混匀,37 ℃水浴过夜。加入相同体积的酚∶氯仿∶异戊醇(25∶24∶1)150 μL抽提,加入2.5倍体积的预冷无水乙醇,振荡混合20 s,于室温放置2 min沉淀双链DNA。4 ℃离心30 min,小心吸去上清液,倒置离心管于一纸巾上,使剩余液体挥发。加入50 μL TE缓冲液溶解DNA。
根据结核分枝杆菌 HBHA基因序列设计引物:P1(5'-CACGGATCCATGGCTGAAAACTCGAA CAT-3',下划线部分为BamHI酶切位点)、P2(5'-CTGAAGCTTACTACTTCTGGGTGACCTTC-3',下划线部分为HindⅢ酶切位点),由TaKaRa公司合成。以H37Rv基因组为模板,以P1和P2为引物,扩增目的基因。PCR反应条件:94℃ 60 s,55℃ 60 s,72℃ 90 s,共30个循环;再于72℃延伸7 min。1.2%琼脂糖凝胶电泳鉴定PCR结果。
用胶回收试剂盒回收目的片段,将目的基因与质粒PQE-80L同时用BamHI与HindⅢ 37 ℃双酶切2 h,经1.2%琼脂糖凝胶电泳后切胶回收。以3∶1的比例混合,用T4连接酶于16 ℃过夜连接,转化DH5α感受态细胞,然后涂布于LB平板(含100 mg/L氨苄青霉素),37 ℃培养过夜。随机挑取3个菌落,分别接种于5 mL LB培养液(含100 mg/L氨苄青霉素)中,37 ℃振荡培养过夜。利用Promega公司提供的质粒提取试剂盒提取重组质粒,进行序列测定(由上海生工生物工程公司完成),将序列正确的质粒命名为PQE-80L-HBHA。
按文献[ 3]的方法进行重组质粒的表达。
以IPTG终浓度0.3 mmol/L和5 h的条件诱导大量重组蛋白表达。将IPTG诱导后400 mL菌液10 000 r/min(离心半径8 cm)离心5 min收菌,弃上清,用20 mL PBS缓冲液重悬,冰浴条件下超声5次,每次10 s,分别收集裂解沉淀和上清,加2×上样缓冲液混匀,煮沸10 min,12 000 r/min(离心半径5 cm)离心10 min,留取上清进行非变性聚丙烯酰胺凝胶电泳(SDS-PAGE)。重组蛋白多出现在菌体破碎后的上清中,表明以可溶性形式存在。将超声裂解后的上清通过已用Binding buffer平衡的His Gravitrap柱上,再用10 mL的Binding buffer冲洗柱子,最后用3 mL的Elution buffer将蛋白洗脱并收集。取纯化的重组HBHA蛋白100 μg,经背部皮内多点注射成年雄性新西兰白兔,制备多克隆抗体[ 3]。
参照文献[ 3]的方法进行。收集各浓度梯度洗脱蛋白后取少量样本进行SDS-PAGE电泳,并用免疫印迹法鉴定天然HBHA蛋白。
参照文献[ 3]的方法进行。用7H9液体养基37 ℃培养BCG至稳定期,取培养液下层的BCG菌体,放入已加有少量Tween-80的磨菌瓶内,在振荡器上磨菌混匀。用7H9液体调节菌液浓度至 A600nm≈0.2,再以1∶10的比例接种到含新鲜7H9培养基的六孔板中。然后每孔分别加入不同浓度(0、0.2、0.5、2.0、5.0 μg/mL)的HBHA蛋白。37 ℃培养36 h,在倒置显微镜下观察。
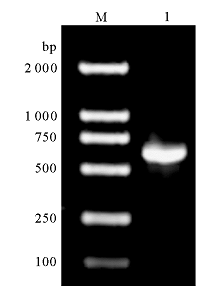
应用所设计的引物进行 HBHA基因扩增。从结核分枝杆菌H37Rv基因组DNA中获得特异性的DNA片段,约600 bp,见 图2。
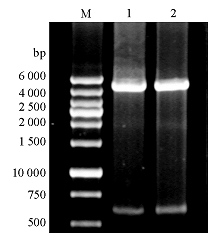
将经BamHI与HindⅢ双酶切后的目的基因片段与PQE-80L载体连接,筛选重组质粒,经酶切鉴定证实有600 bp的片段插入载体,初步确认为正确的重组表达载体,命名为PQE-80L-HBHA,见 图3。经测序证实PQE-80L-HBHA为正确的重组质粒。
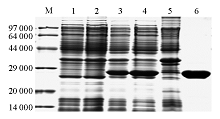
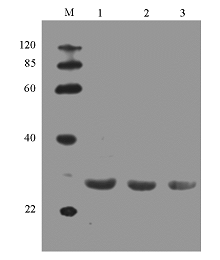
含PQE-80L-HBHA的重组BL-21菌株在相对分子质量约28 000处有浓重的表达条带出现。经凝胶薄层扫描,测得重组菌表达带的蛋白量约占菌体总蛋白量的36%。对蛋白的进行可溶性分析证明,表达产物主要以可溶性蛋白的形式存在,见 图4。将表达蛋白与抗His的特异性抗体做免疫印迹,发现在相对分子质量28 000处有一条带,见 图5。最终以0.3 mmol/L IPTG 5 h诱导大量重组菌,将超声裂解后的上清加到His Gravitrap亲和层析柱上,洗脱下结合的蛋白。12%SDS-PAGE仅见1条回收蛋白带,未见其他杂带,光密度扫描分析表明其纯度为92.1%。见 图4。
收集各NaCl浓度的洗脱液,并上样SDS-PAGE电泳,仅见一条回收蛋白带。用BCA法测定各浓度的蛋白含量。当NaCl浓度为342 mmol/μL时,回收的蛋白浓度较大[ 4]。结果显示提取的纯化天然HBHA蛋白可以与抗重组HBHA抗体特异结合。见 图6。
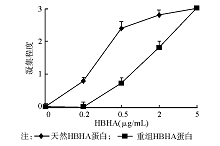
重组HBHA蛋白和天然HBHA蛋白均有诱导BCG聚集的作用。其中天然HBHA蛋白在0.5 μg/mL时BCG即可出现明显的聚集,而重组HBHA蛋白在2 μg/mL时BCG才出现聚集现象。当HBHA浓度达到5 μg/mL时,天然HBHA蛋白和重组HBHA蛋白均诱导BCG出现明显的聚集现象,且2组的聚集效果相似。见 图7。具体凝集现象见文献[3]。而将HBHA与相应抗体孵育后,BCG的凝集反应被抑制。
近年来,结核分枝杆菌黏附素在结核病发病中的作用及其在诊断治疗中的应用已经引起较多的关注[ 5]。寻找具有保护机体免受有毒结核杆菌攻击的抗原,深入研究结核病免疫学有关特性和免疫谱,可以为结核病新的诊断技术研究提供依据。
目前已知,HBHA除可结合人肝素血凝素外,还可结合补体C3,并富有抗原性,可刺激机体产生相应抗体,诱导致敏T细胞分泌γ-干扰素(IFN-γ)[ 6]。因此其临床诊断和疫苗价值令人瞩目。但据报道[ 7]称,重组HBHA蛋白由于缺乏天然HBHA蛋白的甲基化特点,而在HBHA的黏附作用以及诱导T细胞免疫作用方面明显减低。为此,本研究旨在对重组HBHA蛋白活性及其诱导产生的抗体的活性进行鉴定,以确认重组HBHA蛋白的临床诊断应用价值。
本研究表明,从结核分枝杆菌H37Rv基因组DNA中获得特异的HBHA DNA片段的大小与文献[ 8]报道相符;含PQE-80L-HBHA的重组BL-21菌株出现的表达条带的大小与文献[ 9]报道相符。重组HBHA蛋白具有诱导BCG聚集的作用,但活性稍低于天然HBHA蛋白。说明HBHA的甲基化在该活性中的作用并非必需。由重组HBHA蛋白诱导产生的多克隆抗体可以完全抑制天然HBHA蛋白和重组HBHA蛋白聚集BCG的效应更充分证明了这一点。本研究结果提示,由重组HBHA蛋白诱导产生的多克隆抗体及重组HBHA蛋白在检测血液中相应的HBHA抗原和抗体中具有潜在临床诊断价值。
重组HBHA蛋白诱导产生的多克隆抗体在抑制结核分枝杆菌感染过程中的其他作用尚待进一步确认。但已有研究[ 10]发现,重组HBHA蛋白与BCG联合免疫接种后,机体的保护性免疫应答有明显增加。说明重组HBHA蛋白作为疫苗所诱导产生的抗体除了可抑制HBHA诱导的BCG聚集活性之外,还可抑制HBHA的其他辅助感染活性。
在张旭霞等[ 11]的研究中,分别以重组和天然HBHA蛋白为包被抗原,用酶联免疫吸附试验(ELISA)检测肺结核、肺外结核组及结核菌素(PPD)阳性组、PPD阴性对照组血清中抗HBHA抗体水平。结果显示肺结核组和肺外结核组的抗体水平高于PPD阳性组和PPD阴性对照组( P<0.01)。重组和天然HBHA蛋白均有较高特异性和敏感性,且天然HBHA蛋白诊断肺外结核的敏感性和特异性高达95%以上,这为结核病早期诊断提供了新的方向。基于HBHA可以刺激T淋巴细胞释放IFN-γ的特性,Hougardy等[ 12]通过提取活动性结核组、隐匿型结核组以及健康阴性对照组的外周血单个核细胞进行体外培养。然后分别以PPD、结核杆菌早期分泌蛋白-6(ESAT-6)、HBHA刺激细胞分泌IFN-γ,检测IFN-γ释放水平。结果显示HBHA在诊断隐匿型结核病时敏感性为92.06%,特异性93.88%。并且敏感性和特异性均高于PPD和ESAT-6诱导释放组。说明HBHA在隐匿性结核病的诊断中有着不容忽视的作用[ 13]。
重组HBHA蛋白的表达及其抗体的制备成功,为结核分枝杆菌感染监测试剂盒的研制奠定了坚实基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|