通讯作者:朱晴晖,联系电话:021-32274550-2502。
作者简介:金姝,女,1975年生,博士,中级检验医师,主要从事肿瘤免疫与分子生物学研究。
探讨乳腺癌C-erbB-2蛋白表达与基因CpG岛甲基化状态和mRNA表达的关系。
方法取经病理确诊的52例乳腺癌组织,分别用甲基化特异性聚合酶链反应(MSP)、免疫组织化学法(IHC)和逆转录-聚合酶链反应(RT-PCR)检测
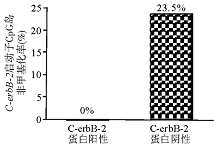
C-erbB-2蛋白阴性和阳性的2组乳腺癌组织的非甲基化率分别为0%和23.5%,CpG岛低甲基化与C-erbB-2蛋白表达呈显著正相关(
To investigate the correlation of the of C-erbB-2 protein expression with the metlylation pattern of gene CpG island and the mRNA expression in breast cancer.
MethodsThe methylation patterns of
The non-methylation rates of
The hypomethylation of CpG island in the gene promoter of
乳腺癌是女性最常见的恶性肿瘤,甲基化紊乱是乳腺组织癌变病因学的早期事件,导致许多癌基因激活和抑癌基因失活,促进异常细胞的增殖[ 1]。Samowitz等[ 2]统计分析了文献报道的在乳腺癌中呈高或低甲基化的基因,有7个基因低甲基化(1 -SYNU-CLEIN、 c-myc、 MAGE、 NOEY2 /ARHI、 Sat2、 SATR1 /SATR2、 UPA),41个基因高甲基化。乳腺癌中 C-erbB-2(又称 Her-2 /neu)基因的阳性率可达70.60%,C-erbB-2蛋白阳性的乳腺癌显示高侵袭性和大量DNA甲基化,预后较差。但 C-erbB-2基因的甲基化状态与其蛋白表达及乳腺癌之间的关系尚未见报道。我们采用甲基化特异性聚合酶链反应(MSP)、逆转录-聚合酶链反应(RT-PCR)和免疫组化(IHC)测定乳腺癌组织 C-erbB-2启动子区CpG岛的甲基化、 C-erbB-2 mRNA水平和C-erbB-2蛋白表达水平,分析癌基因 C-erbB-2激活机制与 C-erbB-2启动子区CpG岛的低甲基化的关系。
2009年1月至2010年12月上海市普陀区人民医院手术治疗并经病理确诊的乳腺癌患者52例,均为女性,年龄35~89岁,临床资料完整。按照美国癌症联合委员会(AJCC)乳腺癌TNM分期第6版(2003年)分期标准分为0期7例、I期14例、II期25例、III期6例。术后立即从肿瘤标本中取癌组织和癌旁组织(距离肿瘤中心3 cm及以外处、外观正常的组织,均避开坏死、炎症部位,经病理确认),置-70 ℃冰箱保存备用。供病理学分析的癌组织和癌旁组织按常规用甲醛固定24 h,行石蜡包埋后备用。
1、主要试剂 蛋白酶K (CALBIOCHEM公司),氯仿(上海大合化学品有限公司);苯酚 (0.1 mol/L Tris饱和,pH值8.0);DNA修饰试剂盒CpGenomeTM DNA Modification Kit(Chemicon公司);dNTP Mix 2 mmol/L each、Taq DNA Polymeraser、RevertAid First Strand cDNA Synthesis Kit (Fermentas公司);琼脂糖(Biotech公司);SYBR Premix Ex Taq (宝生物工程有限公司);TRIzol Reagent (Invitrogen公司)。
2、主要仪器 Gene Quant II 型RNA/DNA Caculator(Pharmacia Biotech公司);Neofuge 15R型高速冷冻离心机(上海力申科学仪器有限公司);S1000 thermal cycler聚合酶链反应(PCR)扩增仪(Bio-Rad公司);Tanon 1600R凝胶成像分析系统(上海天能仪器有限公司);-70 ℃ ELT-13V-85V35型超低温冰箱(HARRIS公司);T25 basic匀浆机(ULTRA TURRAX公司);LightCycler荧光定量PCR仪(Roche公司)。
1.组织DNA的提取 每份标本用剪刀剪取0.30.5 cm3大小的组织块,尽量剪碎,加500 μL Tris-乙二胺四乙酸(EDTA)缓冲液溶液(TES),用匀浆机对组织进行匀浆,将匀浆好的组织转移到1.5 mL的无菌Eppendorf (EP)管中。采用常规的苯酚、氯仿、异戊醇抽提法获得DNA并测定浓度。
2.DNA的亚硫酸氢盐修饰及修饰效果的判断 采用修饰试剂盒CpGenomeTMDNA Modification Kit。取1 μg DNA按说明书操作,碱性条件下变性10 min后加入亚硫酸氢钠50 ℃修饰16 h,用乙醇脱盐,最后获得TE洗脱经修饰的DNA 10 μL。在RNA/DNA Caculator上测定浓度后,置-20 ℃保存。
3.野生型引物扩增 修饰前、后的DNA各用野生型引物扩增,以修饰前引物用野生型引物扩增有目的产物,而修饰后无扩增产物判为修饰成功。引物由生工生物工程(上海)有限公司合成。反应体系共计20 μL:10×PCR buffer 2 μL,Mg2+(25 mmol/L) 1.2 μL、dNTP(各2 mmol/L) 2 μL、20 pmol/μL野生型正向引物(WF) 0.5 μL、20 pmol/μL野生型反向引物(WR) 0.5 μL、模板DNA 100 ng、Taq酶(5 U/μL)0.5 μL,加双蒸水(ddH2O)至20 μL,加石蜡油1滴。PCR扩增条件为预变性95 ℃ 5 min,变性95 ℃ 30 s,退火60.9 ℃ 30 s,延伸72 ℃ 30 s,34个循环;72 ℃延伸10 min。扩增产物在1.5%琼脂糖凝胶电泳,凝胶成像系统下观察结果。
4.甲基化和未甲基化引物扩增 引物由生工生物工程(上海)有限公司合成。反应体系同上。PCR扩增条件为预变性95 ℃ 5 min;变性95 ℃ 30 s,退火46.6 ℃ 30 s,延伸72 ℃ 30 s,34个循环;72 ℃延伸10 min。扩增产物在1.5%琼脂糖凝胶电泳,凝胶成像系统下观察结果。
5 RNA的提取 按照Trizol试剂盒提供的方法提取细胞的总RNA。每份标本用剪刀剪取0.30.5 cm3大小的组织块。常规氯仿分离、异丙醇沉淀RNA后,75%乙醇洗涤、干燥RNA沉淀,加入适量DEPC水溶解,紫外分光光度计测定RNA的浓度,同时测定 A260 nm和 A280 nm值以鉴定RNA的纯度。-80 ℃保存备用。
6.RT反应 按照RevertAid First Strand cDNA Synthesis Kit (Fermentas公司)操作。
7.real-time PCR反应 参照SYBR Premix Ex Taq试剂盒说明书操作。 C-erbB-2 mRNA的相对表达量用2-△CT值表示,其中△CT=CT靶基因-CT内参基因。引物序列见 表1。
| 表1 引物序列 |
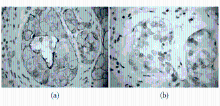
8.C-erbB-2蛋白表达的IHC测定 石蜡包埋组织切片经脱蜡、脱水后,经枸橼酸抗原修复液(pH值6.0)进行抗原修复。滴加一抗,4 ℃过夜。PBS洗涤,滴加二抗,置于37 ℃电热恒温水浴箱30 min。滴加二氨基联苯胺盐酸盐(DAB)显色,镜下见棕黄色颗粒后终止反应。苏木精复染,盐酸酒精分化。纯乙醇脱水,二甲苯透明,中性树脂封片。用已知染色结果为阳性的乳腺癌标本作为阳性对照,用PBS取代一抗作阴性对照。膜染色根据美国食品药品管理局(FDA)推荐的Hercep Test评分系统,即0:完全没有着色或<10%肿瘤细胞有细胞膜着色;1+:>10%的肿瘤细胞呈现微弱不完整的细胞膜着色;2+:>10%的肿瘤细胞呈现弱至中度完整的细胞膜着色;3+:>10%的肿瘤细胞呈现强的完整的细胞膜着色。2+和3+视为阳性。
采用SPSS12.0统计学软件包,有关数据采用χ2检验,相关分析采用Spearman相关分析法, P<0.05表示差异有统计学意义。
共收集乳腺癌组织标本52例,其中C-erbB-2蛋白阴性35例(24例0,11例1+)、阳性17例(11例2+, 6例3+),阳性率32%。
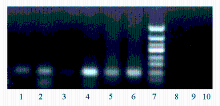
乳腺癌组织甲基化和未甲基化的 C-erbB-2基因启动子CpG岛的MSP产物电泳结果见 图1。52例乳腺癌组织中有4例非甲基化,均发生于C-erbB-2蛋白阳性的17例乳腺癌标本中。35例C-erbB-2蛋白阴性的乳腺癌标本中未发现非甲基化。
在C-erbB-2蛋白阴性的乳腺癌标本中非甲基化率为0%,而在C-erbB-2蛋白阳性的乳腺癌标本中非甲基化率为23.5%,见 图2、3。 C-erbB-2基因启动子CpG岛低甲基化与C-erbB-2蛋白表达呈显著正相关( r=0.413, P=0.03)。
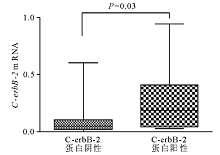
C-erbB-2蛋白阴性的组织标本中 C-erbB-2 mRNA表达量为0.098±0.041,明显低于蛋白阳性组mRNA表达量(0.20±0.062, P=0.03),见 图4。 C-erbB-2 mRNA表达与C-erbB-2蛋白表达呈显著正相关( r=0.356, P=0.03)。
乳腺癌 C-erbB-2 mRNA表达、C-erbB-2蛋白表达和 C-erbB-2基因启动子CpG岛的甲基化水平与与患者的年龄、月经情况、TNM分期、淋巴结转移等均无明显相关性( P≥0.05)。见 表2。
| 表2 乳腺癌 C-erbB-2 mRNA表达、癌蛋白表达和基因启动子CpG岛的甲基化水平与临床病理参数的关系 |
肿瘤的发生发展是一个多因素、多阶段逐渐累积的过程,并涉及癌基因激活和抑癌基因失活。DNA 的甲基化这一表观遗传改变是癌基因的活化及抑癌基因失活的重要机制之一,肿瘤中存在全基因组的低甲基化和正常非甲基化的CpG岛的高甲基化的普遍现象。抑癌基因局部CpG岛的高甲基化会阻碍转录因子复合物与DNA结合,使基因表达抑制,基因沉默失活;而癌基因的低甲基化可促使癌基因活化,过度表达;基因组范围的低甲基化增加了染色体的不稳定性,使转座子异常表达,上述机制都与肿瘤的发生发展密切相关[ 3, 4]。
癌基因 C-erbB-2定位于染色体17q21,编码相对分子质量为185 000的跨膜蛋白,是表皮生长因子受体(EGFR)家族的成员,具有细胞内酪氨酸激酶样活性,通过不同的信号传导通路,最终导致细胞无序增殖和恶性转化。C-erbB-2蛋白的过度表达在细胞的分裂、增殖、转化、促进肿瘤的转移、侵袭、黏附中起重要作用[ 5, 6]。已知C-erbB-2蛋白在包括乳腺癌在内的多种肿瘤中过度表达。有文献报道该蛋白过表达与基因的扩增、突变有关[ 79],但也有学者认为C-erbB-2蛋白过表达与该基因的扩增无明显相关性[ 10, 11],提示除基因的扩增和突变外,可能存在该基因激活的其他机制。有关癌组织 C-erbB-2基因启动子区甲基化与蛋白表达关系的报道极少,仅有Holzmann[ 12]和Hattori[ 13]分别用甲基化敏感性限制性内切酶-Southern blot和甲基化敏感性限制性内切酶-PCR研究了胃肠道癌和卵巢癌中的甲基化状态,并分析与基因表达的关系,但结论不一致。有学者[ 14]曾就 C-erbB-2基因启动子区CpG岛的低甲基化与结肠癌组织中C-erbB-2蛋白过度表达的关系进行了研究,发现癌组织中的 C-erbB-2基因低甲基化与癌组织中C-erbB-2蛋白的表达量呈显著相关。
有研究报道癌基因低甲基化导致癌基因过度表达。Ortmman等[ 15]报道,在黑色素瘤特异性抗原PRAME呈过度表达的急性髓系白血病(AML)患者的骨髓标本中, PRAME基因第一内含子的15CpG岛明显呈低甲基化,而在健康供者的外周血标本和 PRAME阴性的AML患者骨髓标本中该位点完全甲基化, PRAME的甲基化水平既可作为肿瘤标志物成为对白血病微小残留病监测的一个有效标志,也可做为免疫治疗的潜在靶点。Ito等[ 16]报道在乳腺癌和结直肠癌标本中,胰岛素样生长因子2(IGF2)的启动子近侧序列的低甲基化率(分别为33%和80%)显著高于癌旁组织,导致IGF2的表达上调,对结直肠癌有一定的诊断意义。
本研究发现乳腺癌C-erbB-2蛋白的高表达与 C-erbB-2启动子CpG岛的低甲基化相关,与 C-erbB-2 mRNA的表达呈正相关,说明 C-erbB-2基因启动子的低甲基化可能在C-erbB-2蛋白过度表达中起一定作用,可能是继基因突变和基因扩增外,导致癌蛋白过度表达的机制之一。乳腺癌C-erbB-2蛋白高表达的机制复杂,除基因和表观遗传水平的调控外,与肿瘤免疫编辑亦有关[ 17]。Kmieciak等[ 18]报道由T细胞介导的靶向抗肿瘤免疫应答可导致原发肿瘤中的C-erbB-2抗原缺失,从而有助于肿瘤逃逸,其机制与IFN-γ诱导 C-erbB-2基因启动子甲基化有关。由于DNA甲基化程度的变化是一种表观遗传修饰,是潜在可逆的。因此,本研究为探讨在基因水平上控制C-erbB-2蛋白表达的治疗药物的靶点选择提供依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|