通讯作者:沈佐君,联系电话:0551-2283840-801
作者简介:李道静,女,1981年生,学士,主要从事临床生物化学研究
建立柱上堆积高效毛细管电泳法同时检测细胞内氨甲蝶呤(MTX)及其6种代谢产物氨甲蝶呤多聚谷氨酸链( MTXPG )的方法。
方法采用高效毛细管电泳技术,以75 mmol/L磷酸盐缓冲液( pH值7.40 )作为分离介质,用水和乙腈( V/V=1∶1 )作溶剂重组残留样本的方法进行柱上样本堆积,0.5 psi压力进样,进样时间50 s,在分离电压28 kV、检测波长300 nm条件下对MTX和MTXPG进行分离。在此基础上,检测细胞内MTX及其代谢产物MTXPG的含量。
结果通过不断改变分离缓冲液中异丙醇(5%、8%、10%,V/V)和羟丙基-β-环糊精( hp-β-CD )浓度(20、25、30 mmol/L),发现在含8%异丙醇、25 mmol/L hp-β-CD的缓冲液条件下,30 min内实现7种组分的完全分离。用水和乙腈( V/V=1∶1 )作溶剂重组残留样本进行柱上样本堆积的方法可使检测灵敏度提高10倍。
结论建立柱上样本堆积高效毛细管电泳法可同时检测细胞内MTX及其代谢产物MTXPG。该方法具有高效、快速、简便、高灵敏度的特点。
To establish a method for simultaneous determination of methotrexate(MTX) and its 6 metabolites methotrexate polyglutamate (MTXPG) in cells by on-line sample stacking capillary electrophoresis.
MethodsThe eletrophoresis buffer was 75 mmol/L Na2HPO4 (pH=7.40). The voltage of 28 kV was applied and the injection time was 50 seconds at 0.5 psi. The separation of MTX and MTXPG was performed at a wavelength of 300 nm, and sample stacking was achieved by using distilled water and acetonitrile (V/V=1∶1) as dissolvent. Under optimal condition, intracellular MTX and MTXPG levels were detected by capillary electrophoresis.
ResultsThe optimal condition was made by adjusting isopropanol concentration(5%, 8%, 10%, V/V) and hp-β-CD concentration (20, 25, 30 mmol/L). Seven substances were completely separated by capillary electrophoresis in 30 min. A 10 fold improvement in the amount of distilled water and acetonitrile (V/V=1∶1) could be achieved by on-line sample stacking method.
ConclusionsMTX and MTXPG in cells can be simultaneously separated by high-performance capillary electrophoresis efficiently, rapidly, conveniently and super-sensitively.
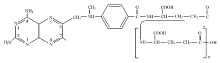
氨甲蝶呤(MTX)作为叶酸代谢途径中抗肿瘤药物的“基石”,主要应用于治疗急性淋巴细胞白血病、淋巴瘤、绒毛膜上皮癌、乳腺癌、头颈部癌、膀胱癌和肺癌等。小剂量应用可治疗一些非癌性疾病如银屑病、类风湿性关节炎等。MTX为叶酸类似物,主要借助于还原性叶酸载体(reduced folate carrier, RFC)进入细胞,进入细胞的MTX在胞浆和线粒体内2种亚型的叶酰聚谷氨酸合成酶(folypolyglutamate synthetase,FPGS)的作用下形成MTX多聚谷氨酸链(methotrexate polyglutamine,MTXPG),即链接上2~7个长度不等的谷氨酰链(MTX-Glu n,n=27 ),见 图1。
MTXPG为MTX在细胞内的活性代谢产物,其聚集量和链的长度决定着MTX细胞毒性和治疗效果[ 1]。MTXPG,尤其是大于3个链的存在于细胞内的时间比MTX长。因为其相对分子质量较大,不容易从细胞内溢出,所以能产生更强的细胞毒作用。同时,许多机理表明MTXPG链越长,长链所占比例越多,MTX对肿瘤细胞的杀伤作用越好。MTXPG的检测有利于评估治疗效果、指导药物用量、减少药物不良反应[ 2]。目前临床上关于MTX常规检测大部分是MTX血药浓度监测,对细胞内MTX及其代谢产物的检测报道较少[ 3]。细胞内MTXPG的检测通常采用高效液相色谱法进行分析。国、内外关于毛细管电泳法检测细胞内MTXPG的报道甚少。我们通过柱上样本堆积技术,成功地对MTX及其6种代谢产物MTXPG进行完全分离。
MTX、MTX-(Glu)2、MTX-(Glu)3、MTX-(Glu)4、MTX-(Glu)5、MTX-(Glu)6、MTX-(Glu)7(瑞士Sckircks Laboratory公司),羟丙基-β-环糊精(hp-β-CD)(美国Sigma公司),BECKMAN P/ACETM MDQ型毛细管电泳仪,毛细管柱(河北永年锐沣色谱器件公司),256 nm PDA检测器、32 Karats of software V7.0软件(美国Beckman-Coulter公司)。
准确称取磷酸氢二钠2.686 1 g,hp-β-CD 4.49 g,溶于100 mL双蒸水中,用磷酸调节pH值至7.40,4 ℃保存。每次使用时,取4.6 mL缓冲液,加0.4 mL异丙醇,反复颠倒混匀。
将MTX、MTX-(Glu)2、MTX-(Glu)3、MTX-(Glu)4、MTX-(Glu)5、MTX-(Glu)6、MTX-(Glu)7 标准品母液用水和乙腈(V/V=1∶1)稀释至5 μmol/L。毛细管长度60 cm、毛细管直径75 μm、毛细管温度25 ℃、PDA检测器λ= 300 nm条件下进行检测。新的毛细管使用前分别用1 mol/L HCl溶液、去离子超纯水、1 mol/L NaOH溶液、去离子超纯水、电泳缓冲液活化20 min。每次使用前依次用1 mol/L NaOH溶液冲洗 3 min、0.1 mol/L NaOH溶液冲洗3 min、电泳缓冲液冲洗3 min、去离子超纯水0.1 psi压力进样2 s、样本 0.5 psi压力进样50 s,分离电压28 kV,30 min内可实现各组分的完全分离。
将标准品母液分别用0.01 mol/L NaOH溶液、水和乙腈(V/V,1∶1)稀释,各组分终浓度为5 μmol/L,然后上机检测。0.5 psi压力分别进样5、50 s。观察两者峰性、峰面积以及柱效的变化。
以非小细胞肺癌A549细胞株为研究对象,用含10%新生牛血清的RPMI-1640培养基,在5% CO2、37 ℃条件下进行孵育培养。将处于对数生长期的细胞加入MTX,孵育24 h,台盼蓝染色,细胞计数108 个。立即收集细胞,4 ℃下1 000 r/min(离心半径12 cm)离心10 min,弃上清,用冰的PBS洗涤2 次,采用细胞匀浆器破坏细胞,显微镜下观察,直到细胞完全破坏为止。14 000 r/min(离心半径6 cm)离心15 min,细胞裂解液定容至500 μL,加100 μL 20%高氯酸,充分振荡混匀10 s,14 000 r/min(离心半径6 cm)离心15 min去除蛋白,上清液加20 μL饱和的氢氧化钠,将样本通过3 mL Sep-pakC18柱[配制 6 mL溶液A(98%水、2%乙腈、0.1%甲酸)和4 mL溶液B(20%水、80%乙腈、0.1%甲酸)],依次用2 mL溶液B活化、4 mL溶液A冲洗、上样、2 mL溶液A冲洗、2 mL溶液B洗脱,样本在56 ℃下用氮气吹干,溶于50 μL水和乙腈(V/V=1∶1)中,上机检测。
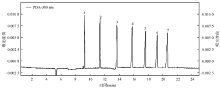
通过不断优化分离缓冲液中hp-β-CD浓度(20、25、30 mmol/L)、磷酸氢二钠浓度(50、75、100 mmol/L)、异丙醇浓度(5%、8%、10%)、pH值(7.20、7.40、7.60)和分离电压(20、25、28 kV),发现分离MTX及其代谢产物的最佳电泳条件为:在75 mmol/L磷酸盐缓冲液(pH值7.40,含25 mmol/L hp-β-CD、8%异丙醇),0.5 psi压力分别进样50 s,分离电压28 kV,检测波长300 nm条件下进行样本分离。标准物质图谱见 图2。
将50 μL 5 μmol/L MTX、MTX-(Glu)2、MTX-(Glu)3、MTX-(Glu)4、MTX-(Glu)5、MTX-(Glu)6、MTX-(Glu)7 7种标准品溶解于500 μL细胞裂解液中,与样本处理方式相同[加100 μL 20%高氯酸,充分振荡混匀10 s,14 000 r/min(离心半径6 cm)离心15 min去除蛋白,上清液加20 μL饱和的氢氧化钠,将样本通过3 mL Sep-pakC18柱,样本在56 ℃下氮气吹干,溶于50 μL水和乙腈(V/V=1∶1)中],然后上机检测。与过柱子前的50 μL 5 μmol/L标准品比较,发现各组分的样本回收率均在90%以上。连续5 d处理同一样本,分析其样本前处理批间变异系数( CV),见 表1。
| 表1 MTX及其代谢产物的样本回收率和重复性 |
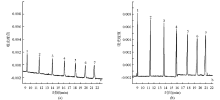
用水和乙腈(V/V=1∶1) 溶解的5 μmol/L标准品0.5 psi压力分别进样50 s,与进样时间5 s相比,可获得柱前10倍的浓缩效果而保持较好的柱效。结果见 图3。说明该方法可用于柱上样本富集,提高检测灵敏度。
通过不断减少各种标准物质浓度,以信噪比(S/N)=2为标准,确定的最低检测灵敏度MTX、MTX-(Glu)2、 MTX-(Glu)3为0.2 μmol/L,MTX-(Glu)4、MTX-(Glu)5、MTX-(Glu)6、MTX-(Glu)7 为0.5 μmol/L。
用水和乙腈(V/V=1∶1)不断稀释改变MTX及MTXPG标准品的浓度,混合物重复配制3次,毛细管电泳法检测5次,求峰面积的平均值。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线见 表2。结果显示MTX及MTXPG浓度-峰面积具有良好的线性关系,相关系数达到0.99以上。
| 表2 MTX及其6种代谢产物的回归方程 |
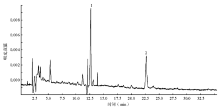
为了验证本方法在检测细胞内MTX及其代谢产物的含量方面应用的可行性,将处于对数生长期的非小细胞肺癌A549细胞加入50 μmol/L MTX,孵育24 h,细胞计数108个。按照上述样本处理方法,上机检测。通过加入标准品进行样本峰的确认。电泳图谱见 图4。
MTXPG存在细胞内,含量非常低,且其各组分浓度相差较大,各分子式间相差1~6个谷氨酸残基,同时分离和检测细胞内MTXPG各组分的难度非常大。目前关于MTXPG的检测方法有高效液相色谱法和毛细管电泳法。高效液相色谱法检测MTXPG常用的定量方法[ 4, 5]有:(1)放射性核素标记3H MTX法,该方法灵敏度较高,能够定量MTXPG每一个组分,但耗时较长,设备要求较高;(2)通过抑制二氢叶酸还原酶(DHFR),根据还原型辅酶Ⅱ(NADPH)量的变化进行定量,但缺乏特异性;(3)荧光法,该方法特异性高、敏感性强,但不能分离和定量长链MTXPG。毛细管电泳法检测MTXPG方法的出现,使得操作简便、省时省钱、无需特殊设备直接进行检测。但毛细管电泳法也有其自身不足之处,如由于进样体积较少,灵敏度不高[ 6, 7]。本研究采用柱上样本堆积技术使检测灵敏度提高1个数量级,为毛细管电泳法分析微量超微量样本提供新的思路[ 8]。通过不断优化分离条件,对MTX及其6种代谢产物进行完全分离,并结合固相萃取技术成功地对细胞内MTX及其代谢产物进行检测。本研究结果表明样本回收率>90%,回归方程相关系数>0.99,柱上样本堆积法可使灵敏度提高10倍,最低检出线>0.5 μmol/L。说明该方法重复性好、灵敏度高、快速(30 min内完成样本分离)、方便(不需大量配制缓冲液和特殊仪器)、经济,适合于临床样本检测。
由于MTXPG存在细胞内,细胞内含有大量的蛋白质,给毛细管电泳的检测带来极大的困难。本研究比较了几种蛋白质沉淀剂:因MTX不溶于甲醇和乙腈,故不能用甲醇和乙腈作为蛋白质沉淀剂;10%三氯乙酸容易使MTX链发生断裂;用高氯酸杂峰少,且使蛋白质沉淀更完全,同时为了防止高氯酸浓度过高破坏MTXPG,选择20%高氯酸。使用Sep-pakC18柱的目的:一方面使大量的样本体积浓缩到几十微升,提高检测灵敏度;另一方面可以去除蛋白和高盐对样本分离的影响。实验过程中,本研究发现样本在56 ℃下用氮气吹干的方法浓缩样本,对检测结果影响不大。
MTXPG的检测有利于评估治疗效果、指导药物用量、减少药物不良反应。MTX治疗患者的疗效很大程度上取决于个体对药物的不良反应差异、对药物的敏感性、细胞内MTXPG含量和链的长度。检测细胞内MTXPG有助于监控患者的治疗情况,准确地判断预后。如Stamp等[ 9]对低剂量MTX治疗的类风湿性关节炎患者进行MTXPG药物浓度和药物代谢动力学监测,对治疗效果进行预判。本研究实现了MTX及其代谢产物MTXPG的完全分离, 将为MTXPG研究提供新的研究方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|