作者简介:蒯守刚,男,1975年生,硕士,主管技师,主要从事临床微生物检验和耐药机制研究。
研究临床分离的2株亚胺培南耐药的大肠埃希菌分子耐药机制。
方法通过琼脂稀释法检测亚胺培南耐药的大肠埃希菌对多种抗菌药物的敏感性,采用肠杆菌科基因间重复性一致序列(ERIC)-聚合酶链反应扩增分析(PCR)对耐药菌株进行同源性分析,采用特异性PCR和序列分析、接合试验、质粒提取和质粒消除试验检测耐药菌株的分子耐药机制。
结果大肠埃希菌对包括碳青霉烯类和喹诺酮类在内的多种抗菌药物耐药,同源性分析显示2株菌株属于同一克隆型,PCR和序列分析显示耐药株菌携带KPC-2、qnrA、TEM-1和I类整合酶基因并且伴有外膜蛋白OmpK36基因的缺失,质粒提取和质粒消除试验证实KPC-2和I类整合酶基因定位于约54 kb质粒。
结论大肠埃希菌中出现质粒型碳青霉烯酶基因KPC-2,并且同时携带其他耐药相关基因,表现为多重耐药,KPC-2合并外膜蛋白缺失是大肠埃希菌对碳青霉烯类耐药主要机制。
To study the molecular resistance mechanism of 2 isolates of carbapenem-resistance
Agar-dilution was used to detect the sensitivities of carbapenem-resistance
Two clinical isolates were resistant to carbapenems, fluoroquinolones and carbapenem antimicrobial agents. ERIC-PCR analysis showed that 2 isolates belonged to identical genotype. PCRs and DNA sequence analysis confirmed that the isolates contained KPC-2, qnrA and I-integrase gene associated with deficiency of OmpK36(outer membrane protein K36) gene. Plasmid DNA extraction and elimination of plasmid from 2 isolates indicated that KPC-2 and I-integrase gene encoded on a 54 kb plasmid.
ConclusionsMultiple drug-resistant
在治疗肠杆菌科细菌尤其产超广谱β-内酰胺酶(ESBLs)和头孢菌素酶(AmpC酶)的肠杆菌科细菌引起的感染时,碳青霉烯类药物由于具有良好的抗菌活性而一直是临床的首选药物。然而随着这类抗菌药物在临床的大量使用,国内外已有碳青霉烯类耐药肠杆菌科菌株的报道[ 1, 2],给临床治疗和院内感染的控制带来了新的挑战。介导此类药物耐药主要机制是产碳青霉烯酶、高产ESBLs和AmpC酶合并外膜蛋白的缺失等。我们对临床分离2株亚胺培南耐药的大肠埃希菌相关耐药基因型进行了研究。
1. 菌株来源 2株亚胺培南耐药的大肠埃希菌W1和W2分离自重症监护病房(ICU)住院患者痰液和血液,菌株鉴定采用VITEK32全自动细菌鉴定系统。标准菌株为大肠埃希菌(ATCC 25922)和铜绿假单胞菌 (ATCC 25923)。接合试验受体菌为大肠埃希菌 C600,由浙江大学附属一院俞云松教授惠赠。
2. 试剂与仪器 Vitek细菌鉴定仪:法国BioMerieux公司;核酸扩增仪:eppendorf 公司;全自动DNA测序仪:上海英骏公司ABI-3730测序仪;质粒提取试剂盒:德国QIAGEN产品;质粒DNA凝胶回收试剂盒:上海申能博彩公司产品。
1. 抗菌药物敏感试验 采用琼脂稀释法检测抗菌药物的最低抑菌浓度(MIC),药物敏感性试验操作及结果判读参照美国临床实验室标准化协会标准(CLSI 2007)。
2. 染色体DNA同源性分析 采用肠杆菌基因间重复性一致序列(ERIC)-聚合酶链反应(PCR)对大肠埃希菌进行基因组同源性分析,引物设计参考文献[ 3]。PCR扩增条件为:95 ℃预变性7 min,95 ℃变性30 s,50 ℃退火1 min,65 ℃延伸8 min,30个循环,65 ℃延伸16 min。
3. 碳青霉烯酶与其他β-内酰胺酶基因扩增与测序 采用PCR扩增碳青霉烯酶基因和β-内酰胺酶基因,包括blaKPC、blaIMP、blaVIM、blaSME和blaOXA 5种碳青霉烯酶基因和blaCTX、blaTEM、blaSHV 3种β内酰胺酶基因。煮沸法提取细菌DNA,引物及扩增条件参考文献[ 2, 410]。扩增产物送上海英骏公司测序,测序结果在GenBank网上比对分析。
4. 质粒接合试验 受体菌为利福平耐药的大肠埃希菌C600。挑取供体菌和受体菌单个菌落接种于2 mL LB肉汤, 37 ℃摇床180 r/min(离心半径3.5 cm)培养4 h。各吸取供体菌和受体菌菌液0.5 mL置于1.5 mL U型管中混匀。37 ℃静置培养4 h。吸取混合菌液100 μL均匀涂布于含抗菌药物的水解酪蛋白胨(MH)平板(本试验采用含1 mg/L美罗培南和256 mg/L利福平)。37 ℃静置培养14 h后挑取单个克隆再次移种含复合抗菌药物平板过夜培养,然后制DNA模板用PCR进行阳性接合子的验证。
5. 质粒提取、质粒指纹图谱分析和质粒消除试验 按Qiagen Maxi质粒提取试剂盒操作说明提取质粒DNA, 以1倍三羟甲基氨基甲烷(TAE)作为电泳缓冲液,用含1%溴化乙啶浓度为0.8%琼脂糖凝胶作为支持物,80 V/cm条件下电泳2 h后拍照。对2株大肠埃希菌进行质粒消除试验,受试菌株接种于4 mL MH肉汤37 ℃ 200 r/min(离心半径3.5 cm)摇床过夜培养,吸取40 μK培养液移种于含1.0%十二烷基硫酸钠(SDS)的新鲜MH肉汤中,200 r/min(离心半径3.5 cm)摇床过夜培养,如此反复多次后,吸取菌液移种于MH琼脂平板,挑取单个菌落移种于MH琼脂平板后做亚胺培南敏感性试验,敏感者可能为质粒丢失株,再提取质粒分析。
6. 外膜蛋白基因扩增 PCR扩增大肠埃希菌外膜蛋白ompK35、ompK36基因,引物序列及相关信息参考文献[ 11],PCR产物经测序后进行基因序列分析。
7. I类整合酶基因、I类整合子可变区及qnr基因扩增 引物序列与反应条件参考文献[ 12]。
亚胺培南和美罗培南对大肠埃希菌W1和W2的MIC为64或32 mg/L,对包括氨曲南在内的其他所检测的β-内酰胺类抗菌药物均高水平耐药,对阿米卡星敏感,对左氧氟沙星和环丙沙星耐药。W1和W2相应质粒消除株和原始菌株相比,对碳青霉烯类和β-内酰胺类敏感性均明显改变,而对环丙沙星和左氧氟沙星敏感性无明显改变,见 表1。
| 表1 大肠埃希菌(W1,W2)和相应质粒消除株(X1,X2)药敏测定结果(mg/L) |
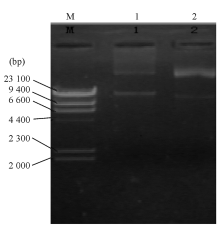
2株大肠埃希菌采用ERIC-PCR进行基因组同源性分析,W1和W2耐药株扩增产物电泳后的条带大小及数量完全相同,认为属于同一克隆型,见 图1。
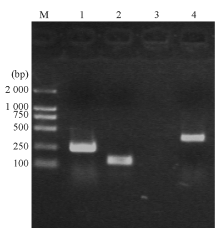
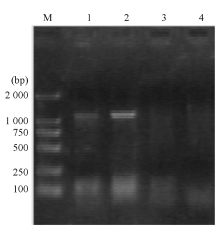
大肠埃希菌W1和W2 的blaKPC、 blaTEM 、qnr和I类整合酶基因均扩增阳性,相应质粒消除株blaTEM 和qnr基因扩增阳性,经测序和比对分析分别为KPC-2、TEM-1、qnrA基因( 图2,3)。I类整合子可变区扩增未获成功。外膜蛋白基因ompK35、ompK36基因扩增和序列分析显示耐药株缺失OmpK36,见 图4。
4. 质粒电泳分析和质粒消除试验 通过对泛耐株质粒电泳条带进行切胶回收DNA,以特异性PCR进行质粒分析显示KPC-2和I类整合酶基因均定位于相对分子质量为54 000的质粒上, 而未扩增出TEM-1和qnrA基因。菌株经质粒消除试验后均未提取到质粒,且相应质粒消除株X1和X2对包括碳青霉烯类在内的大部分抗菌药物耐药性丢失,对喹诺酮类药物保持抗药性,但MIC值下降2个稀释倍数。
碳青霉烯类药物作为治疗革兰阴性杆菌感染的最有效药物之一,在临床得到广泛应用并也取得良好疗效。但近年随着此类药物的大量使用甚至过度治疗,临床也相继分离到了革兰阴性杆菌的耐药株,尤以非发酵菌为主,肠杆菌科细菌耐药菌株的报道近年也逐渐出现[ 1315]。无锡市传染病医院发现的2株泛耐型大肠埃希菌在同一病区被分离到,通过基因组同源性分析显示属于相同的流行克隆株,提示耐药株是通过垂直传播途径进行播散并有爆发流行的危险。通过质粒分析和基因型研究发现介导对碳青霉烯类抗菌药物耐药KPC-2基因和I类整合酶基因定位于相对分子质量为54 000的质粒上,KPC-2基因是否作为整合子的基因盒的组成部分从而参与耐药机制的形成,在本研究中整合子可变区扩增未成功而未得到证实。耐药菌株经质粒消除试验后未提取到质粒,并且对碳青霉烯类等多类药物抗性丧失或明显下调,而对喹诺酮类药物保持抗性,但MIC值有轻微下降,推测qnrA和TEM-1基因可能定位于染色体上,而左氧氟沙星和环丙沙星的MIC值下降可能由于耐药菌株经质粒消除剂十二烷基硫酸钠(SDS)处理后菌株的细胞膜脂质成分发生改变,通透性增加而使MIC值下调。另外首先分离到泛耐株的患者有多次转院的病史,因此,携带KPC-2基因的质粒是外院引入还是长期碳青霉烯类抗菌药物作用压力下分离株产生了首发于无锡市传染病医院的携带KPC-2基因的耐药性质粒,这一推测有待于进一步研究证实。
我们采用接合试验对耐药性的传递机制进行研究未获成功,本研究分析不同菌株的接合条件是否存在一定的差异,还是该质粒是一个大质粒,接合成功率可能比较低,或是液相接合试验中混合菌液的相互比例不协调等因素影响。另外质粒作为独立于染色体之外具有自我复制和表达功能的基因单元,是否具有传递性有赖于性菌毛的存在,性菌毛作为一个中空的管状结构仅存在于少数革兰阴性杆菌中,是否存在性菌毛缺陷或缺失机制的参与有待进一步探讨。
外膜蛋白基因扩增结果显示,耐药株缺失Omp36外膜蛋白基因,结果和Yight 等[ 16]所报道的缺失Omp36膜孔蛋白有所差异,外膜孔蛋白是抗菌药物进入细菌胞体内与靶位点结合发挥抗菌作用的特异性通道,缺失可导致药物的内渗作用下降,从而参与介导耐药。本研究中2株耐碳青霉烯类抗菌药物的大肠埃希菌可能缺失OmpK36外膜蛋白,进而参与碳青霉烯酶KPC-2介导的多重耐药机制,因此,临床微生物实验室应重视KPC酶与其他碳青霉烯酶的检测以及加强耐药株的流行病学研究,对指导临床合理用药,控制耐药菌株的传播具有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|