通讯作者:应春妹,联系电话:021-68383299。
作者简介:郑冰,女,1984年生,学士,主要从事临床微生物检验及细菌耐药性监测工作。
评价内转录间隔区(ITS)的多态性序列分析(rDNA-ITS序列分析)对临床少见丝状真菌的鉴定作用,以形态学鉴定方法加以补充验证。
方法将3株待检真菌通过聚合酶链反应(PCR)扩增和基因测序方法分析rDNA-ITS序列,从GenBank获取相似序列,使用BLAST工具对rDNA-ITS序列进行对比分析,利用GenBank中的系统发育软件自动生成系统,构建系统发育树,根据系统发育树并结合对比指标确定距离与同源性均有较大鉴定意义的对比序列,并与真菌ITS1、ITS2、26S rDNA D1/D2片段的序列分析结果及形态学鉴定结果进行比较。
结果2株菌株能通过rDNA-ITS序列分析的方法鉴定到种,另1株由于相似序列较多,需要形态学方法加以配合鉴定。rDNA-ITS序列分析相对真菌ITS1、ITS2、26S rDNA D1/D2片段有更好的真菌鉴定作用。
结论相对于传统形态学方法,利用rDNA-ITS序列分析鉴定丝状真菌不受检验人员经验水平影响,较为客观,同时由于其包含的信息量相对丰富,因此,较其他靶序列具有更好的真菌鉴定作用。但该方法也存在一定局限,因此,仍需结合形态学方法进行鉴定。
To evaluate the internal transcribed spacer(ITS) regions as targets for molecular identification of clinical uncommon filamentous fungus, and use the method as the verification and supplementary check to the morphological identification.
MethodsThe rDNA-ITS regions of 3 filamentous fungi were detected by polymerase chain reaction(PCR) amplification, and the PCR products were sequenced and compared with the data in GenBank. The function of BLAST in GenBank auto-generating system for phylogenetic tree and comparative indicators was helpful to determine the high homologous sequences.The results should be compared with the morphological identification and the results of ITS1,ITS2 and D1/D2 region of 26S rDNA as the targets.
ResultsThe assay successfully identified 2 strains of filamentous fungi to species, and another strain should be identified with the help of morphological characteristics of the strain since too many similar sequences in the results. It was superior to the ITS1, ITS2 and 26S rDNA D1/D2 targets in the fungal identification.
ConclusionsCompared with the traditional morphological identification methods,the rDNA-ITS sequence analysis is more objective and be with few influence from the experience level of operators. This method with more information has the better effect of fungus identification by comparing with other target sequences. However, this method still has its limitation, so it requires a combination of morphological identification.
目前临床侵袭性真菌感染发生率不断升高,真菌感染病原谱扩大,不同抗真菌药物又有不同抗菌谱,为了协助临床制定合理有效的抗真菌治疗方案,改善患者的预后,早期、迅速、准确地鉴定致病真菌显得尤为重要。流行病学调查表明,真菌病原谱的覆盖已远远超出烟曲霉和酵母菌属[ 1],过去少有报道的真菌感染不断增加。因此,对于一些临床较为少见的丝状真菌,采用传统的形态学鉴定方法极易受到实验室人员个人经验的影响,必须阅读大量文献、查阅相关书籍,结合菌落特征以及显微镜下孢子形态、产孢特点等进行综合考量以得出正确结果。基于内转录间隔区(internal transcribed spacer, ITS)的多态性序列分析(rDNA-ITS序列分析)由于不受上述限制,且序列的长度适中,使人们可以从不太长的序列中获得足够的信息,已成为真菌分类鉴定研究的重点[ 2, 3, 4],目前广泛应用于真菌属内不同种间或近似属间的系统发育研究中[ 5]。本研究将ITS全长序列与真菌ITS1、ITS2、26S rDNA中D1/D2片段进行聚合酶链反应(PCR)扩增测序,比较其在真菌鉴定中的作用,并将其与传统形态学鉴定结果进行比较,以评价ITS全长序列分析在丝状真菌鉴定中的作用。
1. 菌株来源 本次研究中的3株真菌除2号菌株分离自粪便标本外,其余2株均分离自痰液,同时对其进行形态学鉴定以及真菌ITS1、ITS2、 26S rDNA D1/D2片段以及ITS全长序列分析。
2. 主要试剂 PCR试剂购自TaKaRa公司;真菌DNA抽提试剂盒为Biospin Fungus Genomic DNA Extraction Kit(上海Bior,Cat.NO:BSC14S1)。
1. 菌种分离培养及形态学鉴定 将标本接种至沙保弱(SDA)培养基,分别置25及37 ℃培养,观察真菌菌落大小、形态、颜色和质地。培养出的丝状真菌采用小培养的方法[ 6],观察显微镜下菌丝,孢子和分生孢子形态、生长方式、颜色等,从而鉴定丝状真菌至种。
2. 丝状真菌4种序列分析 丝状真菌DNA抽提采用真菌DNA基因组提取试剂盒:Biospin Fungus Genomic DNA Extraction Kit(上海Bior,Cat.NO:BSC14S1),按照操作步骤进行,最后将抽提的DNA于-20 ℃保存备用。(1)rDNA-ITS扩增:PCR反应体系总体积50 μL扩增全长序列ITS,其中10×PCR缓冲液 (含MG2+)5 μL,10 μmol/L通用引物ITS1(TCCGTAGGTGAACC-TGCGG)、ITS4(TCCTCCGCTTATT GATATGC)各2 μL,2.5 μmol/L dNTPs 4 μL,TaKaRa Taq酶(5 U/μL)0.3 μL,模板DNA 2 μL,无菌蒸馏水加至50 μL。反应条件:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸60 s,共30个循环;72 ℃总延伸7 min;(2)ITS1和ITS2扩增: PCR反应体系同上,扩增ITS1片段的引物为上游 ITS1(TCCGTAGGTGAACC TGCGG)、下游ITS2(GCTGCGTTCTTCATCGATGC);扩增ITS2片段的引物为ITS3(GCATCGATGAAGAACGCAGC)和ITS4(TCCTCCGCTTATTGATAT GC)。反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min, 30个循环;72 ℃总延伸7 min;(3)26S rDNA中D1/D2片段扩增: PCR反应体系同上, D1/D2片段扩增引物为10 μmol/L LR3(GGTCCGTGTTTCA AGA CGG)和F63(GCA-TATCAATAAGCGGAGGAAAAG)。反应条件:94 ℃预变性5 min;94 ℃变性1 min,58 ℃退火2 min,72 ℃延伸60 s,共30个循环;72 ℃总延伸7 min。
将PCR扩增产物用1.5%琼脂糖凝胶进行电泳,EB染色后于凝胶成像仪上判读结果,观察是否扩增出目的条带。扩增出的目的核酸片段由Invitrogen公司纯化后进行正反向测序,将所测得的序列提交美国NCBI的GenBank核酸序列数据库(http:// www.ncbi.nlm.nih/blast)进行同源性搜索。利用GenBank中的系统发育自动生成系统,构建系统发育树,并结合期望值(E value)、一致性(identities)、插入或缺失(gaps)等指标确定具有较大鉴定意义的对比序列。
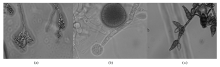
3株丝状真菌在SDA培养基上的形态,见 图1;在显微镜下的形态,见 图2;形态学鉴定结果1号菌株为马内菲青霉;2号菌株为根毛霉属,未鉴定至种;3号菌株为链格孢霉。
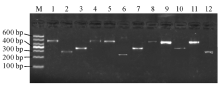
使用真菌DNA抽提试剂盒提取3株丝状真菌DNA,其rDNA-ITS、ITS1、ITS2和26S rDNA D1/D2片段PCR产物经琼脂糖凝胶电泳后均能扩增出目的条带,见 图3。rDNA-ITS和26S rDNA D1/D2片段扩增产物大小在600 bp左右,ITS1和ITS2片段扩增产物在300 bp左右。
截至2010年7月18日BLAST查询结果表明,rDNA-ITS序列分析对于1号菌株(登录号lcl|3387)在GenBank数据库中登录的有3个菌株,见 表1,与其相似度为99%,均为短密青霉( Penicillium brevicompactum),结合GenBank自动生成的系统发育树,具有鉴定意义的是序列AY160203.1( Penicillium brevicompactum)。 2号菌株(登录号lcl|31287)在GenBank数据库中登录的有15个菌株,见 表2,与其相似度为100%,其中卷枝毛霉菌( Mucor circinelloides)13个,结合系统发育树,具有鉴定意义的是序列GQ415044.1( Mucor circinelloides strain FM07)。3号菌株(登录号lcl|45965)在GenBank数据库中登录的有46个具有鉴定意义的菌株,与其相似度为100%,其中主要为链格孢属( Alternaria sp.), 包括链格孢霉( Alternaria alternata)、长柄链格孢( Alternaria longipes) 、极细链格孢( Alternaria tenuissima) 、芸苔链格孢菌( Alternaria brassicae)以及一些未能培养真菌( Uncultured fungus clone)。由于相似菌株太多,结合系统发育树尚不能准确鉴定到种,但结合形态学结果认定其为链格孢霉。ITS1、ITS2和26S rDNA D1/D2序列分析结果与rDNA-ITS鉴定结果的比较,见 表3。
| 表1 1号真菌菌株rDNA-ITS序列有意义的对比序列 |
| 表2 2号真菌菌株rDNA-ITS序列有意义的对比序列 |
| 表3 4种靶序列鉴定丝状真菌结果对比 |
快速准确鉴定病原真菌至种对于改善侵袭性真菌病的预后至关重要。有研究表明,新萨托菌属( Neosartorya spp.)与烟曲霉( Aspergillus fumigatus)仅靠形态学难以区分[ 7]。由于前者在体内对抗真菌药物的敏感性明显低于后者,因此,我们需要一种更为可靠的方法对其加以区分。分子生物学方法则能很好鉴定这2种真菌,以补充形态学鉴定方法的不足。
许多研究表明,利用分子生物学方法鉴定真菌的靶位点rDNA-ITS全长序列优于ITS1和ITS2区域及 26S rDNA中的D1/D2区域,其主要原因可能是大多数真菌ITS区(ITS1-5.8S rDNA-ITS2)的变异率要高于26S rDNA D1/D2区,而其包含的信息量又远大于ITS1及ITS2,因此,ITS全长序列分析更适合作为区别鉴定真菌属内不同种间或近似属间的靶序列[ 810]。我们选择真菌ITS全长序列作为扩增靶位,原因主要有:(1)为多拷贝基因(在真菌基因组中≥100拷贝);(2)有使用较为成熟的真菌通用引物;(3)含高度可变区用于真菌属种鉴定;(4)包含其两端的18S rDNA、28S rDNA 的部分序列和中间的ITS1区、5.8S rDNA、ITS2区的完整序列,拥有相对丰富的信息。Lau等[ 11]研究发现,仅靠ITS1序列分析无法区分新生隐球菌复合种,包括新生隐球菌新生变种、新生隐球酵母格特变种;镰刀菌属,包括轮枝镰刀菌、微胶镰孢菌、层出镰刀菌;新萨托菌属与 Aspergillus lentulus;根霉菌属与淀粉丝菌( Amylomyces rouxii);喙状明脐菌与马克金明脐菌。
实验证明,采用成品试剂盒抽提丝状真菌DNA,扩增ITS全长序列,可以得到较理想的目的片段。本研究中的1号菌株根据其淡青色绒毛状菌落以及镜下帚状枝,初步鉴定为青霉,但由于其帚状枝稍短,因此,怀疑是否为临床常见的马内菲青霉而进行基因序列分析加以验证。rDNA-ITS全长序列分析结果为短密青霉,而其他ITS1、ITS2靶序列分析结果提示为多变拟青霉、踝节菌属或丝衣霉属,26S rDNA D1/D2序列分析结果提示为短密青霉和多变拟青霉。我们查阅相关图片资料等发现短密青霉与我们镜下形态最为符合。2号菌株分离自粪便标本,形态学鉴定为根毛霉属,未鉴定至种;ITS序列分析结果鉴定为毛霉属中的卷枝毛霉与其他3种靶序列鉴定结果较吻合。由于毛霉菌中的属种鉴定专业性较强,常须专家指点,因此,依靠ITS序列分析可减少由于检验人员经验不足所导致种属鉴定的不准确。3号菌株经同源性搜索有相似ITS序列菌株很多,结合BLAST自动生成的系统发育树分析未能准确鉴定到种,而结合形态学结果则发现与链格孢霉相符。因此,我们发现全长ITS序列分析较ITS1、ITS2和26S rDNA D1/D2 3种靶序列的鉴定结果更为可靠,能更好地将临床少见的丝状真菌鉴定到种。
丝状真菌细胞壁厚,破壁反应及其DNA从多糖的包裹中释放出来虽然较为困难,但目前已有成熟的商品化试剂盒,解决了其DNA抽提困难的问题。而PCR反应条件以及核酸序列测定技术的不断成熟更使得利用分子生物学技术作为临床常规手段鉴定丝状真菌成为可能,但这种技术仍然不能取代传统的形态学方法,且必须以形态学为基础。其主要原因有:(1)进行序列比对的数据库仍须不断完善,据估计GenBank中约有10%20%的真菌序列被错误地鉴定为某种病原菌。同时各个数据库每年仍不断有新的序列提交,而过多的相似序列也会给鉴定工作带来困难;(2)核酸的质量,特别是其完整性和纯度都会影响测序结果;(3)当核糖体DNA重复序列之间的纯合度很高时,直接测序可以真实反映ITS区域的序列;但当核糖体ITS重复序列之间的纯合度较低,各个重复序列之间的差异较大时,采用PCR产物直接测定序列,可能会由于测序仪读出多峰而导致无法得到正确的单一序列。因此,需要将ITS序列分析结果与真菌形态学特征相结合,才能更好地正确鉴定丝状真菌。
近年来已发展的一些全新的DNA测序方法,如毛细管凝胶电泳法、陈列毛细管凝胶电泳法、超薄层凝胶板电泳法以及杂交法、质谱法、原子探针法、流动式单分子荧光检测法等,已应用到1TS序列分析中。相信随着分子生物学的不断发展以及真菌形态学鉴定水平的提高,我们一定能更好地将两者结合起来为临床服务。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|